- +1
Nature子刊:告别注射胰岛素,CRISPR筛选找到1型糖尿病中β细胞保护性靶标
原创 BioWorld BioWorld
目前有几个研究团队开发出有效的分化方法,以从人胚胎或诱导性多能干细胞(iPSC)分化出可生成胰岛素的β样细胞。这些研究提高了通过使用自体干细胞衍生的β细胞替代T1D患者中丢失的β细胞的可能性,这种策略具有无限提供细胞的潜力,同时也可以避免移植排斥问题。
然而,这些方法仍然存在关键障碍——在没有免疫抑制的情况下,复发性自身免疫会迅速破坏移植的β细胞。尚不能成功地将可诱导T1D患者对β细胞产生耐受性的免疫疗法从动物模型转化到人类。
迄今为止,最有希望的干预措施是使用抗CD3单克隆抗体——teplizumab,这一由美国生物制药公司Provention Bio开发的单抗药物,最近已被证实可延缓1型糖尿病(T1D)高危人群发病时间至少2年。但目前仍然缺少在没有广泛免疫抑制的情况下逆转1型糖尿病的干预措施。
7月27日,哈佛医学院伊鹏等人在 Nature 子刊 Nature Metabolism 杂志发表了题为:Genome-scale in vivo CRISPR screen identifies RNLS as a target for beta cell protection in type 1 diabetes 的研究论文。
该研究通过体内CRISPR基因组筛选,成功找到了1型糖尿病(T1D)中β细胞的保护性把靶标。抑制RNLS基因可有效保护1型糖尿病(T1D)的β细胞。
该研究还发现了已被FDA批准的药物Pargyline,能够抑制RNLS基因,安全有效地保护β细胞,防止1型糖尿病(T1D)。
这一发现有望解决自身免疫迅速破坏移植β细胞的难题,为彻底治愈1型糖尿病(T1D),告别终身注射胰岛素带来了新希望。

有研究试图通过靶向一系列与免疫识别相关的基因,包括抗原呈递的人类白细胞抗原,来生产免疫原性低下的细胞。尽管这种方法部分有效,但它需要彻底取消用以防止感染和肿瘤形成的免疫监视,因此这种方法有一定潜在危险性。
研究团队推测可能存在在不完全损害免疫监视的情况下防止针对β细胞自身免疫靶向的突变。为了验证这一推测,研究团队使用CRISPR全基因组筛选技术,在T1D小鼠模型中利用自身免疫的选择性压力在自身免疫性糖尿病中进行无偏倚的全基因组搜索,以寻找β细胞存活的修饰因子。

用于1型糖尿病(T1D)的β细胞替代疗法已成为现实,干细胞/β细胞分化的研究进展允许制造数十亿患者来源的β细胞进行移植。这种治疗策略的关键障碍是β细胞对自身免疫的敏感性,只能通过广泛的免疫抑制来消除。
在这项研究中,研究团队通过基因组规模的CRISPR筛选,发现了少数基因突变可使β细胞在患有1型糖尿病(T1D)的宿主中存活。
尽管这是在小鼠模型中进行的筛选,但从严格的实验中筛选到的少数候选基因之一RNLS,该基因已经被全基因组关联分析(GWAS)证实与人1型糖尿病(T1D)相关。来自人类遗传学研究的支持性证据进一步验证了RNLS突变对小鼠和人类β细胞的保护作用。这些数据表明,RNLS基因是导致1型糖尿病(T1D)中β细胞脆弱性的修饰因子。
更重要的是,研究团队进一步找到了一种已被FDA批准的药物——Pargyline,该药物能够结合并抑制RNLS,研究表明Pargyline能够保护β细胞和预防小鼠糖尿病,且具有良好的安全性。
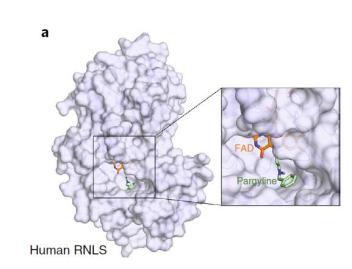
该研究还发现可以将FDA批准的药物Pargyline重新用于抑制RNLS基因,能够保护β细胞,预防糖尿病。
论文链接:
https://www.nature.com/articles/s42255-020-0254-1
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




