- +1
郭晓欢团队揭示肠道微生物通过代谢产物促进抗癌药效的新机制
原创 Cell Press CellPress细胞科学

生命科学Life science
2021年3月23日,清华大学医学院免疫学研究所郭晓欢团队在Cell Press细胞出版社旗下期刊Cell Metabolism在线发表了题为“Gut microbial metabolites facilitate anticancer therapy efficacy by modulating cytotoxic CD8+ T cell immunity”的研究论文,报道了肠道微生物代谢产物丁酸能够通过增强CD8+ T细胞的免疫应答从而提高抗肿瘤药物的疗效。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望,点击“阅读原文”阅读英文原文。
近年来,肿瘤免疫疗法已成为临床上治疗癌症的有力手段,并引发了癌症疗法的范式转变。其中,CD8+ T细胞在肿瘤免疫中起着核心作用。肿瘤微环境(TME)中CD8+ T细胞的浸润减少或功能受损,会导致许多癌症疗法的临床预后较差。因此,促进TME中CD8+ T细胞的浸润和功能将有助于提高癌症治疗的功效。肠道微生物稳态与人类健康息息相关。最近临床数据及动物实验均表明,肠道微生物能通过塑造宿主免疫力来调节化学疗法和免疫疗法中的抗肿瘤功效。肠道微生物可以调节树突状细胞和CD4+ T细胞的应答以提高抗肿瘤疗效。但是,肠道微生物如何调节远端抗肿瘤免疫力,以及肠道微生物是否可以直接调节肿瘤浸润CD8+ T细胞的反应,尚不完全清楚。肠道微生物群能够合成许多代谢产物,部分代谢产物还被发现能够影响机体的免疫反应和癌症的进程。短链脂肪酸(SCFAs)是结肠中含量最丰富的代谢产物,包括乙酸、丙酸和丁酸。研究显示,粪便中SCFAs的浓度与结直肠癌的发生率密切相关,而SCFAs也可以影响CD8+ T细胞的自身免疫反应以改善糖尿病。基于这些结果,研究人员提出猜想,即肠道微生物可能可以通过其代谢产物调节抗肿瘤免疫反应从而影响药物治疗效果。
首先,研究人员发现口服抗生素可以破坏化疗药奥沙利铂的抗癌疗效,向抗生素处理小鼠回输肠道菌群代谢物,可以提高肿瘤微环境中CD8+ T细胞的浸润和功能,进而促进化疗药物的疗效,证明肠道菌群可以通过其代谢产物影响机体抗肿瘤免疫应答以及治疗效果。代谢组学分析显示抗生素处理导致小鼠肠道内的微生物代谢产物组成发生变化,其中短链脂肪酸丁酸的含量显著降低。同时,体外筛选实验显示,丁酸能够显著提高CD8+ T细胞中干扰素-γ(IFN-γ)的表达。不仅如此,回输丁酸至抗生素处理小鼠也能够促进肿瘤中CD8+ T细胞的浸润及功能,并挽救化疗药奥沙利铂的疗效。机制上,丁酸能够通过其组蛋白去乙酰化酶抑制活性促进CD8+ T细胞中转录调节因子ID2的表达,而ID2可以通过调控IL-12信号通路促进CD8+ T细胞的增殖和功能。最后,通过采用皮下肿瘤和自发肠炎相关结肠癌这两种模型,研究人员发现含丁酸盐饲料或丁酸盐腹腔注射均能促进奥沙利铂或PD-L1抗体的抗肿瘤疗效。通过收集奥沙利铂治疗后的结直肠癌患者的血清样本,研究人员还发现对奥沙利铂治疗有较好反应的患者血清中短链脂肪酸(包括丁酸)含量明显高于无反应患者。因此,该研究一方面揭示了肠道微生物可以通过其代谢产物影响抗肿瘤药物疗效的新机制,提示着补充肠道微生物代谢物可能对未来的肿瘤治疗有重要意义,另一方面也为肿瘤的免疫治疗提供了HDAC、ID2等多个新靶点或新思路,为进一步开展新的联合治疗手段奠定有益的理论基础。
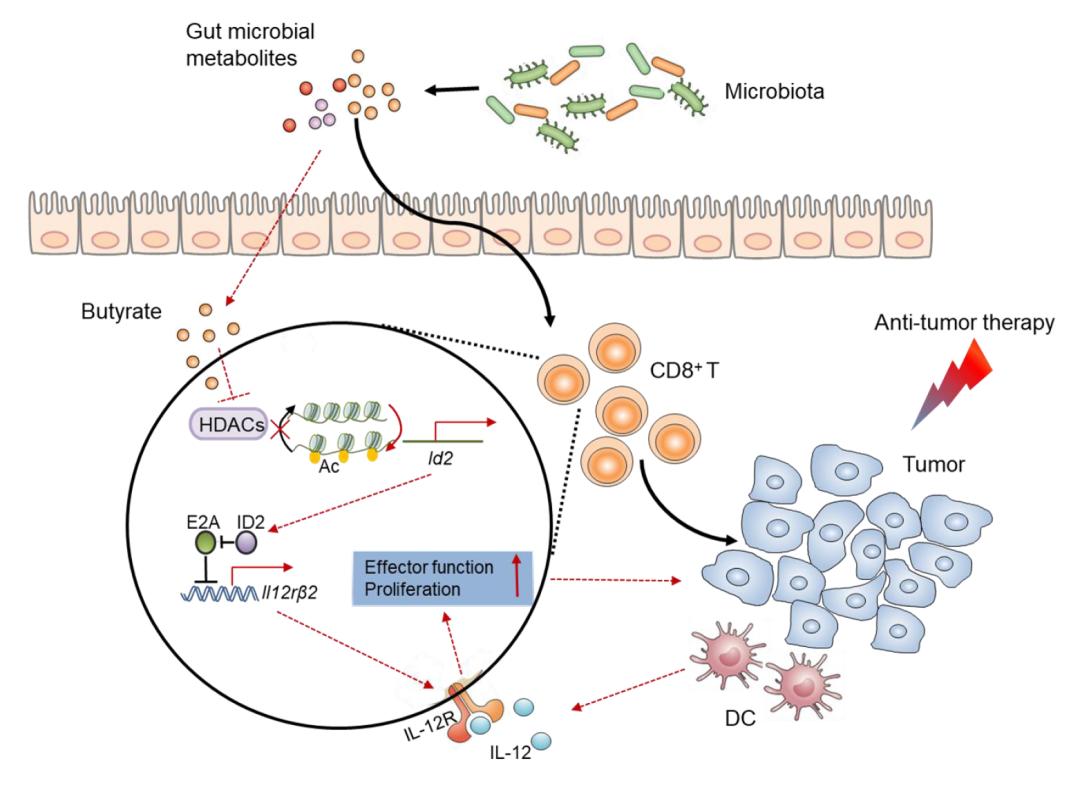
肠道菌群通过其代谢产物短链脂肪酸丁酸,提高CD8+ T细胞中ID2的表达,增强CD8+ T细胞的抗肿瘤免疫应答,从而改善抗肿瘤治疗的效果。
作者专访
Cell Press细胞出版社特别邀请论文通讯作者郭晓欢研究员代表研究团队进行了专访,请他为大家进一步详细解读。
CellPress:请您介绍一下本研究的研究背景。
郭晓欢研究员:近年来,肿瘤免疫疗法已成为临床上治疗癌症的有力手段,并引发了癌症疗法的范式转变。临床数据及动物实验均表明,肠道微生物能通过塑造宿主免疫力来调节化学疗法和免疫疗法中的抗肿瘤功效。最新发表的两项小规模临床试验已经证明在黑色素瘤免疫治疗中,将对PD-1阻断有效的患者粪便菌群移植到无效患者中,能够增强PD-1抗体治疗的疗效。但是,肠道微生物如何调节远端抗肿瘤免疫力,其中很多机制尚不完全清楚。此外肠道菌群非常复杂,如何找到真正有效的菌群或特定菌株面临很多困难。肠道菌群能够合成许多代谢产物,部分代谢产物已经被发现能够影响机体的免疫反应和癌症的进程。我们假设肠道菌群可能可以通过其代谢产物调节抗肿瘤免疫反应从而影响药物治疗效果。如果我们能找到其中活性代谢产物,就可以规避肠道菌群的劣势,直接应用相应代谢产物来帮助我们治疗或辅助治疗肿瘤。
CellPress:肠道菌群会产生多种代谢产物,那么本研究所选的丁酸代谢物在影响肿瘤发展过程中有何特殊作用?
郭晓欢研究员:已有报道表明丁酸可以通过直接调节癌细胞的凋亡或增殖来介导抑癌作用,此外还有报道在小鼠中丁酸还可以通过抑制肠道炎症抑制肠炎相关肠癌的发生。我们的筛选实验发现,在众多肠道菌群代谢产物中,丁酸能够通过其组蛋白去乙酰化酶抑制剂活性促进CD8+ T细胞中转录调节因子ID2的表达,调控IL-12R信号通路促进CD8+ T细胞的活化和抗肿瘤应答。丁酸可以促进奥沙利铂和PD-L1抗体的抗肿瘤疗效,不仅如此,过继回输经其处理的CD8+ T细胞具有更强的抗肿瘤效果,表明丁酸还拥有应用于肿瘤过继性T细胞治疗的潜在价值。
CellPress:CD8+ T淋巴细胞在机体抗肿瘤方面发挥怎样的功能?
郭晓欢研究员:CD8+ T细胞是细胞毒性T细胞,能够释放穿孔素和颗粒酶直接杀伤肿瘤细胞。CD8+ T细胞上表达的FasL能够与肿瘤细胞上表达的Fas结合,诱导肿瘤细胞凋亡。此外,CD8+ T细胞分泌的细胞因子IFN-γ 在抗肿瘤过程中发挥着重要的作用。IFN-γ可以促进抗原提呈细胞(APC)上调MHC Ⅱ的表达,增强其抗原提呈的能力;在IFN-γ刺激下,APC会上调CD86的表达,分泌更多的IL-12、IL-18、IL-27等,进而间接促进Th1细胞的分化和CD8+ T细胞抗肿瘤功能。IFN-γ还可以诱导巨噬细胞一些蛋白酶体的表达,例如通过上调NADPH 氧化酶和一氧化氮合酶(iNOS)等酶的合成,促进ROS和NO的生成。IFN-γ还具有激活NK细胞的能力,增强NK细胞介导的肿瘤细胞杀伤作用。IFN-γ还可以促进CD8+ T细胞本身的活化,增强其抗肿瘤的功效,也能直接增强Th1细胞的分化和免疫能力,促进T细胞趋化因子如MIG和IP-10表达上调,进而促进肿瘤中T 细胞的浸润。
CellPress:转录调控因子ID2是如何调控CD8+ T淋巴细胞的功能的?
郭晓欢研究员:ID2蛋白是拥有螺旋-环-螺旋(HLH)基序的小多肽,但缺少DNA结合域,其功能是与其他HLH蛋白(主要是E蛋白)结合,从而抑制后者与DNA的结合。我们的研究发现,丁酸能够显著提高CD8+ T细胞中ID2的表达,并且相较于淋巴组织,肿瘤中浸润的CD8+ T细胞高表达ID2。机制上,E蛋白E2A可以直接结合到Il12rb2基因的启动子区抑制其表达,而ID2可以通过与E2A竞争性结合而减弱后者的转录抑制活性,从而促进Il12rb2的表达。这说明ID2可以通过与E 蛋白相互作用调节IL-12信号通路,进而调控CD8+ T细胞的抗肿瘤免疫应答。
CellPress:您认为本研究成果对肠道微生物功能研究和抗肿瘤治疗方面有何帮助?
郭晓欢研究员:通过研究抗生素处理对肿瘤治疗的影响,已有文献报道肠道菌群对抗肿瘤药物的疗效至关重要,但是具体的机制还不完善。我们的研究发现,肠道菌群能够通过其代谢产物,尤其是丁酸,直接作用于CD8+ T细胞,促进后者的活化和抗肿瘤免疫反应,这提示了肠道菌群代谢产物对未来的抗肿瘤药物治疗非常重要。另外,我们的结果还说明丁酸可能能够应用于辅助多种抗肿瘤治疗手段,例如丁酸与奥沙利铂或免疫检查点阻断和过继性T细胞治疗等免疫疗法。此外,我们还发现丁酸主要通过其组蛋白去乙酰化酶(HDAC)抑制活性调控ID2表达,我们在小鼠体内与体外细胞实验均证明HDAC抑制剂TSA同样能够激活CD8+ T细胞并促进化疗疗效,因此也提示HDAC抑制剂等表观遗传学修饰手段同样可以与化疗或免疫疗法等联用发挥抗肿瘤作用。
CellPress:接下来,您和您的团队的研究重点会在哪个方面?
郭晓欢研究员:这项研究是从动物模型出发筛选了影响抗肿瘤化疗疗效的肠道菌群代谢产物。但毕竟人鼠差异很大,开始于小鼠的筛选势必丢失很多人群中独有的信息,其中可能就包括真正在患者中能发挥重要作用的肠道菌群活性代谢产物。因此,我们未来将重点放在肿瘤患者相关的肠道菌群活性代谢产物的筛选工作中来,以期发现更多的能够治疗或辅助治疗肿瘤的活性代谢产物。此外,我们也将继续推动已发现的丁酸以及HDAC抑制剂等联合治疗肿瘤的临床相关研究,为肿瘤的治疗提供新的可能。

作者简介

郭晓欢研究员
郭晓欢,清华大学医学院免疫学研究所研究员、博士生导师。2010年获北京大学免疫学博士学位。2010-2015年为美国芝加哥大学病理系博士后。2015年4月起担任清华大学研究员。郭晓欢长期专注于肠道黏膜免疫与菌群稳态调控研究,尤其是新发现的富集于肠黏膜的3型天然淋巴样细胞(ILC3)功能与机制研究,先后鉴定了多个调控ILC3发育和功能的重要因子,发现了ILC3在黏膜稳态以及多种疾病中的新作用及机制,阐明了肠道菌群及其代谢产物影响肠道感染、炎症以及抗肿瘤治疗疗效的作用机制。先后主持和参与基金委、科技部、美国国立卫生院等研究项目。近年来,在Immunity、Cell Metabolism、Science Bulletin、Cell Reports等高水平期刊已发表学术论文28篇,论文他引超过1200多次。

贺瑶博士
贺瑶,2020年获清华大学医学院生物学博士学位,曾就读于黏膜免疫实验室,导师为郭晓欢研究员。贺瑶在博士期间主要从事肠道菌群调控抗肿瘤免疫的机制研究,以共同第一作者身份在Cell Metabolism发表论文一篇。

付榴辉博士在读
付榴辉,清华大学医学院2016级普博生,就读于黏膜免疫实验室,导师为郭晓欢研究员。付榴辉在博士期间主要从事肠道菌群调控抗肿瘤免疫的机制以及哮喘炎症中2型天然淋巴样细胞的代谢和转录调控机制的研究,以共同第一作者身份在Cell Metabolism发表论文一篇。
相关论文信息
研究成果发表在Cell Press旗下Cell Metabolism期刊上,点击“阅读全文”或扫描下方二维码查看论文。
▌论文标题:
Gut microbial metabolites facilitate anticancer therapy efficacy by modulating cytotoxic CD8+ T cell immunity
▌论文网址:
https://www.cell.com/cell-metabolism/fulltext/S1550-4131(21)00109-1
▌DOI:
https://doi.org/10.1016/j.cmet.2021.03.002
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




