- +1
《自然》一日三文关注儿童不明原因肝炎,病毒载体AAV或“背锅”?
“《自然》的文章通过与对照组的比较,提示AAV2感染的比例在患儿中显著更高。这比以往仅仅是在患儿中检测到某个病毒来说,证据强度高了很多。但这仍不能算直接的致病证据,属于是提供了一个值得进一步探索的方向。”
“在之前的认知中,AAV是没有毒性和致病性的一种安全性能很好的病毒载体用于基因治疗,现在这些关于AAV导致肝炎的报道,势必引起人们对其安全性的重新思考。”
当地时间3月30日,《自然》(Nature)杂志连续发表三项独立研究,指出2022年以来的不明原因儿童肝炎病例的增加与2型腺相关病毒(AAV2)这种常见的儿童病毒有关。但三项研究均未明确AAV2究竟为肝炎的致病原因,还是仅仅是对另一种病毒感染的提示。
腺相关病毒(AAV)是一种细小单链DNA病毒,由于公认的安全无害而被广泛用作基因治疗的载体。AAV不能独立复制,需要在辅助病毒,如疱疹病毒或腺病毒存在时,才能进行复制和感染。此前有研究表明,AAV的自然感染可发生在所有年龄段,在儿童1至5岁之间存在一个AAV2感染高峰。
病毒性肝炎是由多种肝炎病毒引起的以肝脏病变为主的一种传染病,目前主要有甲、乙、丙、丁、戊五种病原学分型,除乙型肝炎病毒为DNA病毒外,其余均为RNA病毒。2022年以来,美国、英国等35个国家报告了1000多例病因不明的儿童急性重型肝炎聚集性病例,部分病例很严重,需进行肝脏移植,仅有少数病例有生命危险。
世界卫生组织(WHO)将在全球范围内出现的不明原因儿童急性重症肝炎定义为:自2022年1月1日起,患有急性肝炎(非甲、乙、丙、丁、戊型肝炎病毒引起),且天冬氨酸转氨酶(AST)或丙氨酸转氨酶(ALT)大于500IU/L的10岁及以下儿童。
儿童不明原因肝炎暴发引起广泛关注。由于其出现在新冠大流行期间,一种说法认为,它们的出现与新冠病毒有关。更多专业人士认为,儿童不明原因肝炎和人腺病毒(HAdV)相关。HAdV,特别是HAdV-41,已在英国和美国的急性重症肝炎病例聚集性血液中被发现。
HAdV是无包膜的双链DNA病毒,能在成人和儿童中引起多种感染,包括呼吸器官感染、结膜炎和胃肠炎(引起感染的类型主要是HAdV-40和HAdV-41)。对免疫功能低下的患者来说,HAdV感染可能危及生命,但对于没有潜在合并症、免疫功能正常的儿童来说,HAdV感染引起肝炎是罕见的。
美国阿拉巴马大学伯明翰分校(The University of Alabama at Birmingham)遗传学博士周叶斌向澎湃科技表示,“《自然》的文章通过与对照组的比较,提示AAV2感染的比例在患儿中显著更高。这比以往仅仅是在患儿中检测到某个病毒来说,证据强度高了很多。但这仍不能算直接的致病证据,属于是提供了一个值得进一步探索的方向。”
“那么多儿童肝炎病例中,很可能存在不同的致病机制,这些相关性研究很难单独确证发病原因,如果有进一步的机理研究(如细胞实验、动物模型)能证实AAV2与某些病毒共同感染,可以导致肝细胞损伤(或者再加上特殊的免疫背景),那么就离证实上述文章提出的假说更近了一步。”周叶斌说。
复旦大学生命科学学院青年研究员王鹏飞长期致力于艾滋病、新冠等传染病的防治研究,他告诉澎湃科技,“去年(2022年)下半年就有听说不明原因的儿童肝炎与AAV相关,但是AAV2是否是导致肝炎的直接或者主要原因?如果是,它导致肝炎的机制是什么?这些都是还没有研究清楚的问题。现在只是在病人体内发现了AAV,还需要做动物实验去验证AAV能导致肝炎。”
另一方面,王鹏飞提示,“在之前的认知中,AAV是没有毒性和致病性的一种安全性能很好的病毒载体用于基因治疗,现在这些关于AAV导致肝炎的报道,势必引起人们对其安全性的重新思考。”
美国16例调查:AAV2与辅助病毒共同感染可能让肝炎更严重
3月30日,美国加州大学旧金山分校(University of California, San Francisco)传染病专家邱华彦(Charles Chiu)团队在《自然》杂志在线发表题为《美国儿童急性重型肝炎中的2型腺相关病毒》(Adeno-associated virus type 2 in US children with acute severe hepatitis)的论文,揭示了儿童不明原因肝炎与AAV2及辅助病毒共同感染的相关性。
其团队使用PCR监测、基于病毒富集的测序和宏基因组测序分析了2021年10月1日至2022年5月22日在美国的6个州(阿拉巴马州、加利福尼亚州、佛罗里达州、伊利诺伊州、北卡罗来纳州和南达科他州)登记的16名不明原因儿童急性重症肝炎患者,以及113例对照样本,包括42例(37%)非肝炎患者,30例(26.5%)明确病因的急性肝炎(ALT>100 U/L)患者,23例(21%)急性胃肠炎患者(12例HADV粪便检测阳性)和18例(16%)献血者。
在14例儿童不明原因急性重症肝炎患者的血液中,93%(13/14)检测到AAV2序列,并且在所有14例病例中均检测到HAdV。而113例对照样本中仅有4例(3.5%)检测到AAV2。值得注意的是,对照组中30例明确病因的肝炎患者中未检测到AAV2。
在14例儿童不明原因急性重症肝炎病例中,12例(85.7%)检测到EB病毒(EBV)、人类疱疹病毒6(HHV-6)或肠道病毒A71(EV-A71)的合并感染,对照组中,23例急性胃肠炎(无肝炎)患者中仅有3例(13.0%)合并感染AAV2,研究人员对此表示惊讶。进一步研究显示,与对照组相比,AAV2、EBV和HHV-6与病例显著相关。此外,在AAV2/HADV共感染的病例中,AAV2的病毒载量大约比HADV高了约12.7倍。邱华彦团队表示,此前研究显示,AAV可以抑制其他嗜肝病毒的复制,可部分解释这一观察结果。
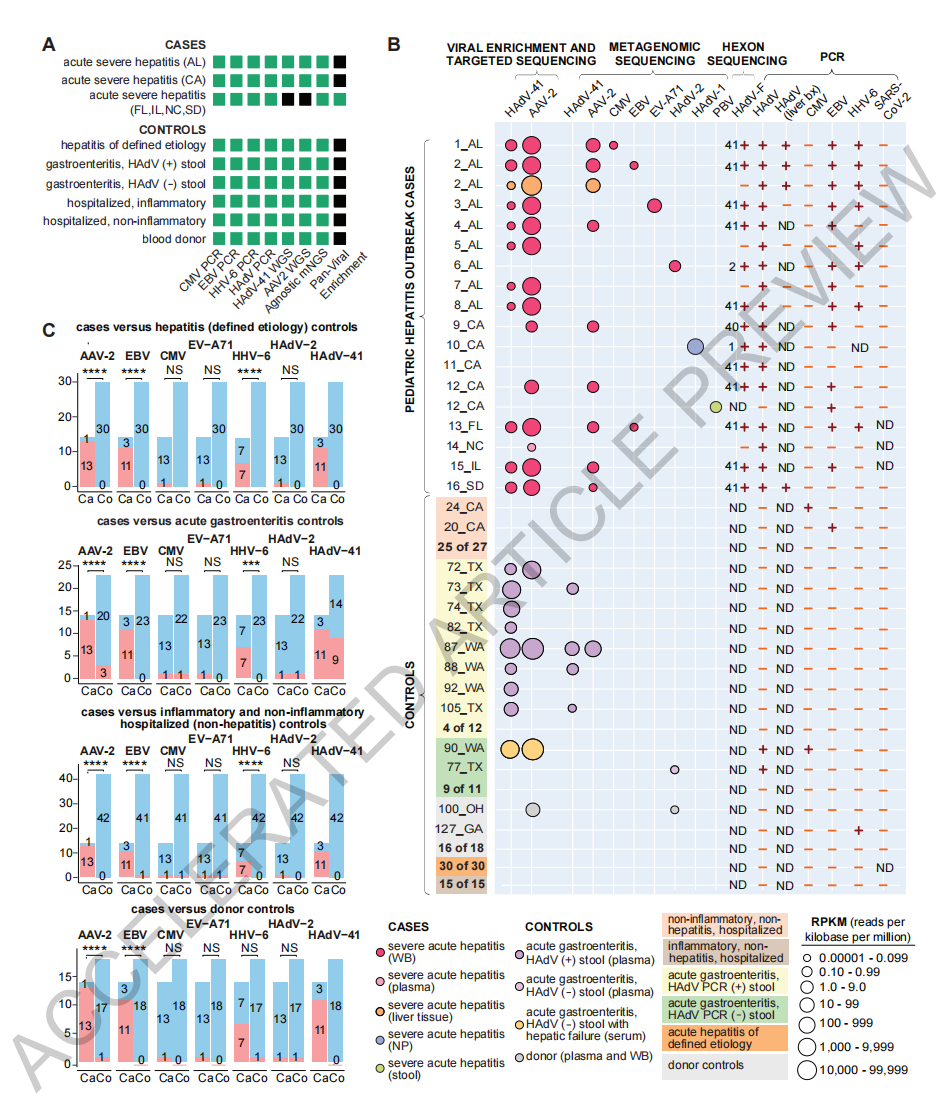
病毒检测和对照研究。图片来源:邱华彦团队论文
邱华彦团队表示,他们的这些发现表明,AAV2和一种或多种嗜肝病毒病原体的合并感染与不明原因儿童急性重症肝炎的临床表现之间存在显著关联,但直接原因未得到证实。他们的研究结果还表明,与腺病毒或疱疹病毒单独感染相比,与AAV2共感染可能导致更严重的肝脏疾病。
不过邱华彦团队也指出,AAV2感染也可能是肝脏炎症的标志物,并非致病原因,需要进一步的研究,如血清学监测、病毒培养和动物模型,以调查AAV2感染在不明原因儿童急性重症肝炎中可能发挥的潜在作用。
英国格拉斯哥大学32例调查:或与AAV2和HLA等位基因相关
3月30日,英国格拉斯哥大学(University of Glasgow)病毒学家艾玛·汤姆森(Emma Thomson)团队在《自然》杂志在线发表了题为《儿童非甲-戊型肝炎的2型腺相关病毒感染》(Adeno-associated virus 2 infection in children with non-A-E hepatitis),报道了AAV2和II型人白细胞抗原(HLA)等位基因DRB1*04:01与不明原因儿童急性重症肝炎暴发的相关性。
“与罕见的人白细胞抗原(HLA)基因型的相关性是很有启发的发现。无论是AAV还是腺病毒,都是比较常见的病毒,可感染肝炎的儿童毕竟是极少数,特殊的HLA基因型可能会让人体对某个病毒产生的免疫反应不同于大多数人,可能在这些肝炎的发病机制里起了作用。”周叶斌告诉澎湃科技。
汤姆森团队招募了32名在2022年3月14日至8月20日期间到医院就诊的不明原因儿童急性重症肝炎患者,并设置了4个对照组,其中第1组为13名年龄范围在3-5岁的健康儿童的血清或血浆;第2组为12名年龄范围在1-4岁的儿童的血清或血浆,经PCR证实为HADV感染,转氨酶正常;第3组为33名年龄范围在2-16岁的儿童,转氨酶均升高,PCR检测为阴性;第4组为2022年3月至4月期间与32名肝炎病例同时住院的16名10岁及以下苏格兰儿童的残余血浆/血清。
通过实时荧光定量聚合酶链反应(qRT-PCR),汤姆森团队在32个肝炎病例中的26个里检测出了AAV2(81%),而对照组中检出AAV2的概率为5/74(7%)。
为研究某些儿童在遗传上是否更加容易患不明原因急性重症肝炎,汤姆森团队对27例肝炎病例和64例苏格兰本地血小板单采供者的对照组进行了所有人类白细胞抗原(HLA,一种帮助免疫系统识别受感染细胞的分子)位点(HLA-A、B、C、DRB1、DRB3/4/5、DQA1、DQB1、DPA1和DPB1)的高分辨率基因分型,发现约25/27(92.6%)不明原因严重急性肝炎患儿携带HLA的一个特殊基因——DRB1*04:01,而对照组的这一比例为10/64(15.6%)。该结果证实了他们的假设,有些儿童可能在遗传学上更容易患上某类肝炎。
汤姆森团队还进行了原位杂交(ISH)独立检测,表明AAV2感染极有可能引发CD4+T辅助细胞介导的免疫反应,这与患病儿童中II类HLA DRB1*04:01等位基因的频率显著增加相一致。
汤姆森团队认为,儿童不明原因严重急性肝炎可能与AAV2的原发感染有关,而不是与其被再次激活有关。汤姆森团队也注意到了AAV2是HAdV感染的非致病性生物标志物的可能性,但她们认为可能性较小,“因为我们没有在肝功能正常的HADV感染儿童对照组中检测到AAV2。”
汤姆森团队指出,还需要对AAV2传播的季节性变化作进一步研究,以及需要更大规模的研究来证实不明原因儿童急性重症肝炎与II型HLA等位基因DRB1*04:01的相关性。
英国伦敦大学学院38例调查:辅助病毒或促进AAV2复制,诱导免疫介导的肝脏损伤
3月30日,英国伦敦大学学院(University College London)病毒学家朱迪思·布鲁尔(Judith Breuer)在《自然》杂志在线发表了题为《儿童不明原因急性肝炎的基因组学研究》(Genomic investigations of unexplained acute hepatitis in children)的论文,同样报道了不明原因儿童急性重症肝炎与AAV2的相关性,并检测到低水平的人腺病毒和人乙型疱疹病毒6B(HHV-6B),他们认为这些病毒或促进了AAV2的复制,潜在诱导了免疫介导的肝脏损伤。
布鲁尔团队使用了基因组、转录组、蛋白质组和免疫组织化学的组合方法,首先对5例肝移植病例的肝活检和5例非移植病例的全血进行了非靶向宏基因组和宏转录组测序,随后又对38例英国儿童不明原因严重急性肝炎病例进行验证性的PCR检测,其对照组为66名年龄匹配的免疫活性对照受试者和21名免疫功能低下的对照受试者。
通过对5例接受肝移植的患者的冷冻移植肝组织样本和5例非移植肝炎患者的6份血液样本进行的宏基因组和宏转录组测序,布鲁尔团队在所有5例接受肝移植的样本中均检测到丰富的AAV2,在非肝移植的6份血液样本的5份中检测到丰富的AAV2。所有肝移植样本中都存在较低水平的HHV-6B,非肝移植的6份血液样本中则没有。
在验证性的PCR检测中,布鲁尔团队对AAV2(28/38)、HAdV(31/38)和HHV-6B(23/38)进行了PCR检测,最终在27/28例患者的肝脏、血液、血浆或粪便中检测到高水平的AAV2 DNA,检测到的腺病毒(HAdV)和人类疱疹病毒6B(HHV-6B)水平较低,HAdV阳性为23/31例,HHV-6B阳性为16/23例。相比之下,即使在严重免疫抑制的情况下,在患有HAdV的对照组儿童的血液或肝脏中也很少检测到低滴度的AAV2。
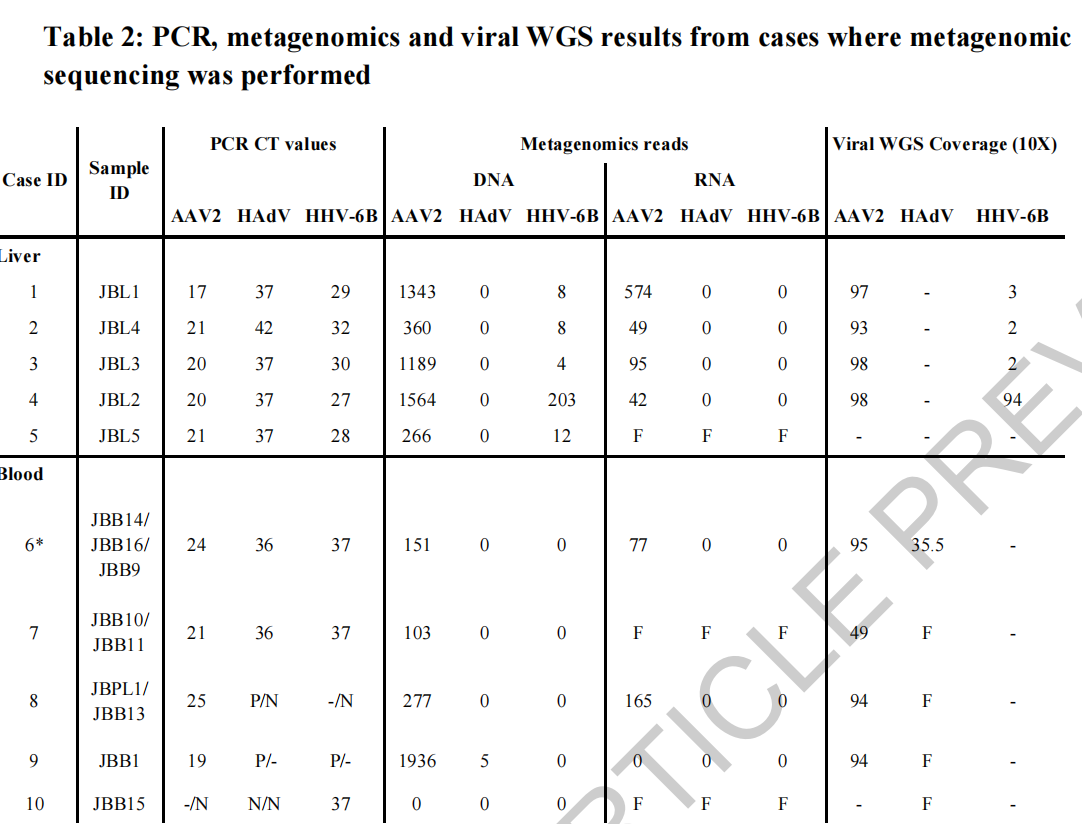
PCR、宏基因组学和病毒WGS结果。图片来源:布鲁尔团队论文
布鲁尔团队表示,尽管不明原因儿童肝炎的发病机制和AAV2在其中的作用仍有待确定,但她们的研究强烈表明这是一个免疫介导的过程。同时布鲁尔团队也指出,其研究有很多局限性,例如调查的病例数量很少,免疫功能低下对照组的年龄不完全匹配等。
与新冠相关?
三项研究均提及了不明原因儿童急性重症肝炎与新冠的关联。
由于检测到多种病毒的共同感染,邱华彦团队推测,“新冠大流行、学校和托儿所关闭两年多以及与其他儿童的社会交往减少,可能产生了一群脆弱的幼儿,由于缺乏接触,他们未能对常见病毒病原体产生广泛的免疫力,从而更易受多种病毒感染,增加了出现更严重疾病的可能性。”
汤姆森团队调查了不明原因儿童急性重症肝炎病例与既往新冠感染相关的可能性。他们在论文中表示,新冠病毒(SARS-CoV-2)直接导致肝损伤是不太可能的,因为他们的肝炎病例很少(31例中只有3例)在入院时新冠病毒PCR检测呈阳性,并且他们没有通过PCR或测序在任何病例的临床样本(包括肝活检)中鉴定出新冠病毒。但他们目前不能完全排除新冠后免疫介导的现象,例如与II型HLA的联系。
他们认为,2022年AAV2相关儿童急性重症肝炎暴发可能是新冠大流行的间接后果。“2020年,通过实施非药物干预措施,包括物理距离和旅行限制,减少了新冠病毒的传播,同时也导致常见人类病毒的传播被阻断,AAV2、HAdV和HHV6B的暴露模式改变了。一旦限制解除,遗传易感儿童同时暴露于HAdV和AAV2的机会更高,从而产生更严重的疾病。”
布鲁尔团队也表示,虽然她们几乎没有发现新冠病毒直接导致不明原因儿童急性重症肝炎暴发的证据,但她们的数据本身并不足以排除奥密克戎(Omicron)的影响。
在一篇同时发表于《自然》的“新闻与观点”文章中,德国柏林夏里特医学院(Charité – Universitätsmedizin Berlin)肝病学和胃肠病学系主任弗兰克·塔克(Frank Tacke)也分析了新冠疫情封控措施的部分影响,“2022年春季的肝炎暴发与全球放宽防疫措施同步发生,之后病例数迅速回落。因此,对暴发时间点的解释可以是儿童在封锁解除后突然接触到了大量病毒,或是因为免疫系统缺乏训练导致他们更容易感染本来无伤大雅的病毒。”




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




