- +1
乳酸菌抗癌新进展,蒙脱石参与菌群肠道定植并激活树突细胞
原创 Cell Press CellPress细胞科学

生命科学Life science
2021年2月9日,来自南京大学的董磊教授团队在细胞出版社旗下期刊Cell Reports上发表Smectite promotes probiotic biofilm formation in the gut for cancer immunotherapy的研究,研究人员基于蒙脱石对乳杆菌形成生物膜的特殊支持作用,开发出一种促进益生菌在肠道定植并进一步激活树突状细胞的新策略,并初步证明了其应用于肿瘤免疫治疗的良好效果。
人的肠道中生活着数万亿的共生细菌,对于维持机体的正常功能发挥重要作用。一方面,当生理环境发生变化,打破肠道菌群的平衡,会加速包括癌症、肠炎、肥胖等多种疾病的发生发展。另一方面,肠道菌群中的乳杆菌、双歧杆菌等益生菌,本身具有激活宿主免疫,增强机体对肿瘤免疫疗法响应的作用。因此,使用益生菌调控免疫系统是一种具有潜力的抗肿瘤策略。目前常用到补充益生菌的方法主要是口服益生菌和粪菌移植,但前者难以在肠道定植,后者存在病原菌感染的风险。开发新的、安全而有效的在体内定植益生菌的方法十分重要。
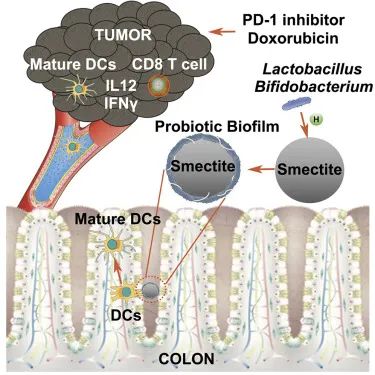
研究者首先测试了口服蒙脱石后小鼠肠道微生物群的变化,发现蒙脱石处理组的小鼠具有更高的乳酸菌和双歧杆菌比例。扫描电镜显示,体外培养的蒙脱石与不同细菌的微球,仅乳杆菌和双歧杆菌能够在蒙脱石颗粒表面形成生物被膜结构。这是由于蒙脱石具有离子交换微观结构,可选择性促进代谢产生乳酸的乳酸菌在其表面上形成生物膜,为乳酸菌抵抗不利环境提供保护。随后,研究者证明了口服蒙脱石能够通过改变小鼠肠道菌群、发挥抑制肿瘤生长的作用。并且,考虑到肠道中固有益生菌的数量较少,研究人员在体外构建了蒙脱石-乳酸菌微球,并喂食黑色素瘤模型小鼠,显示出了比单独使用蒙脱石或乳杆菌更显著的抗肿瘤效果。

那么,定植的乳酸菌是如何发挥作用的呢?研究者在初步机制探索的基础上,进一步使用TLR2基因敲除小鼠和报告细胞模型,揭示了蒙脱石-乳酸菌微球在肠道中,通过TLR2受体介导树突状细胞(DCs)的成熟,刺激CD8+T细胞的增殖,上调细胞因子IL12,IFN-γ等的表达。更为有趣的是,这一机制可将成熟的DCs从肠道组织驱动到肿瘤中,发挥抗肿瘤作用。最后,为考察这一发现的应用潜力,研究者将蒙脱石-乳酸菌微球与化疗或免疫治疗联合使用。在小鼠模型中,与单独使用蒙脱石-乳酸菌微球、阿霉素或PD-1抑制剂相比,蒙脱石-乳酸菌微球联合阿霉素或抗小鼠PD-1抗体均表现出更好的抗肿瘤效果。
作者专访
Cell Press细胞出版社特别邀请论文通讯作者之一董磊教授进行了专访,请他为大家进一步详细解读。
CellPress:首先,请问您为什么会考虑使用蒙脱石这种抗腹泻药物促进益生菌在肠道的定居?
董磊教授:蒙脱石作为用来治疗腹泻等胃肠道疾病的药物,已经在临床上使用了很多年,通常认为蒙脱石是通过吸收水分,调节渗透压,吸附有害微生物等方式达到治疗腹泻的效果。但如果你仔细思考这个机制解释就会发现其中的不合理之处:腹泻时的水分渗出量是很大的,有害菌也会不断增殖,而患者口服蒙脱石的剂量是有限并且相对很小的。一个有限的吸附作用如何能控制住相对无限的致病菌和水分的渗出呢?
所以我们一开始是想考察一下蒙脱石对肠道菌群有没有比较整体的影响。检测结果让我们十分震惊,服用蒙脱石的动物肠道内的乳酸菌和双歧杆菌大幅增加,我们在体外培养物理进一步验证了这个结果,体外培养粪菌如果加入蒙脱石,培养物里几乎全部都是乳酸菌。这个现象一方面解释了我们上面对蒙脱石药物作用机制的疑惑,促进益生菌增殖显然可以有效控制有害菌的增殖,进而治疗肠道感染;另一方面,我们对蒙脱石特异性促进乳酸菌和双歧杆菌增殖的现象十分好奇,于是就进行了深入研究,发现了蒙脱石对产酸的益生菌的响应性吸附以及促生物膜发育过程。在弄清楚机制之后,就很容易想到,可以利用蒙脱石这么一个长期使用的OTC药物来促进益生菌的肠内定植,来解决益生菌临床使用中的基本问题,于是就有了我们文章中的这个比较完整的研究。
CellPress:在体外实验中,双歧杆菌和嗜酸乳杆菌在蒙脱石表面形成生物膜,而枯草芽孢杆菌和大肠杆菌则没有。产生这种特异性的原因是什么?
董磊教授:蒙脱石由于独特的阳离子交换特性,能够在酸性环境交换出离子层间的Ca2+、Mg2+离子,这些阳离子因蒙脱石的负电性聚集在其表面。双歧杆菌和嗜酸乳杆菌都属于一类能够通过代谢产生乳酸的细菌,乳酸在益生菌和蒙脱石之间形成酸性微环境,使细菌表面上带负电的磷壁酸被蒙脱石表面的阳离子所吸引,使这些细菌得以聚集以利于其形成生物膜结构,而枯草芽孢杆菌和大肠杆菌等,由于不能产生乳酸而形成酸性微环境,导致无法在蒙脱石表面聚集吸附,因此无法形成生物被膜。但微生物与环境作用的过程十分复杂,也不能排除有其它的影响因素,我们的后续研究还在继续挖掘这一机制。
CellPress:为什么蒙脱石-乳酸菌生物膜(SLB)复合物具有对抗胃酸和消化酶的强保护作用?
董磊教授:SLB对乳酸菌的保护作用其实主要来自于乳酸菌在蒙脱石表面形成的生物膜(biofilm)。生物膜是细菌和其分泌的基质形成的复杂结构。生物膜的基质部分在材料学结构上比较类似于水凝胶(hydrogel),水凝胶是亲水大分子有序组装成的框架结构,框架中间充满“被固定”的水份,能有效保护内部环境的稳定。同时细菌在生物膜内群居,细菌个体之间的互相沟通更加方便,可以互通有无,甚至在功能上有某些程度的分化,进一步增强了对环境的适应能力。生物膜里的微生物整体上对不良生存环境的抵抗能力比单个细菌要高出上千倍。这是SLB内的乳酸菌能够对抗消化道内的酸和酶的影响的根本原因。
CellPress:能否详细说明SLB的抗肿瘤作用与T细胞免疫反应的激活有什么联系?
董磊教授:基于我们的研究结果,我们目前对这个过程的解释是SLB在肠道内促进了DC细胞的成熟,成熟的DC细胞增强了肿瘤抗原的提呈,并通过IL-12等细胞因子的释放,招募细胞杀伤T细胞至肿瘤部位,进而激活T细胞免疫,杀灭肿瘤细胞。
SLB的活性还是来自于益生菌。益生菌的活性机制目前有很多解释,除了与我们的解释类似的,通过菌体直接作用于免疫细胞之外,还有益生菌通过产生某些代谢产物来活化免疫的研究。综合现在这个领域的研究来看,益生菌活化抗肿瘤免疫的效果是十分确定的,已经有大量基础和临床的研究报告证实了这一点。但对这一过程的发生机制还存在不同解释。考虑到微生物与人体的相互作用的复杂性和动态性,其作用机制很可能是一个多因素的协同过程,并且与具体的病理生理过程有关,因此还需要更深入、更系统的研究来进行分析阐明。
CellPress:为什么TLR2是调节SLB抗癌活性的关键?
董磊教授:根据现有的研究报告,TLR2受体是介导革兰氏阳性细菌(如乳酸菌和双歧杆菌)刺激免疫细胞的关键受体。SLB上的乳酸菌在肠道中通过与树突状细胞表面的TLR2受体接触,激活树突状细胞的分化及成熟,成熟的树突状细迁移至肿瘤部位,通过肿瘤抗原提呈、促进免疫细胞浸润、提高杀伤肿瘤细胞因子释放等方式,发挥抗肿瘤活性。
CellPress:SLB对于不同肿瘤的治疗效果是否存在差异,为什么?
董磊教授:SLB对于不同的肿瘤的治疗效果存在差异,这与免疫系统对不同肿瘤的响应相关。我们之所以选择以恶性黑色素瘤作为主要模型,是由于在既往研究中恶性黑色素瘤表现出来对益生菌疗法的敏感性。同时,我们也测试了SLB在乳腺癌模型小鼠中的治疗效果,发现,虽然单一的SLB治疗在乳腺癌模型中效果不明显,但在联合PD-1抗体治疗时,SLB还是能够发挥不错的效果。因此,虽然单一的SLB在不同肿瘤治疗中效果存在差异,但其与其他药物联合治疗肿瘤的方案的潜力是巨大的。

结语
这一研究,基于蒙脱石对乳杆菌形成生物膜的特殊支持作用,开发出一种促进益生菌在肠道定植并进一步激活树突状细胞的新策略,并初步证明了其应用于肿瘤免疫治疗的良好效果。由于蒙脱石作为腹泻类药物已在全球应用近半个世纪,相关的安全性数据较为充足,使得这种方法具有很高的临床转化潜力。
该研究得到国家自然科学基金、澳门科学技术发展基金的支持。第一作者为南京大学博士研究生韩丛薇,通讯作者为南京大学董磊、张峻峰和澳门大学王春明。南京大学研究生宋金戟、胡俊青、傅蕙洁、兴振与澳门大学研究生冯雁贤、母若雨,濠江博士后学者王珍珍、王琳涛等亦作出重要贡献。
相关论文信息
研究成果发表在Cell Press旗下Cell Reports期刊上,点击“阅读全文”或扫描下方二维码查看论文。
▌论文标题:
Smectite promotes probiotic biofilm formation in the gut for cancer immunotherapy
▌论文网址:
https://www.cell.com/cell-reports/fulltext/S2211-1247(21)00019-X
▌DOI:
https://doi.org/10.1016/j.celrep.2021.108706
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




