- +1
九千万抑郁症患者迎来新进展:治疗药物神秘靶点结构首次绘出
抗抑郁症药物开发又现新进展。发表在国际学术期刊《自然》(Nature)上的一项研究显示,抗抑郁症药物的神秘靶点结构被发现,一个长达31年的预言被证实。
抑郁症与频繁的自杀事件经常联系在一起,让这种疾病更加神秘而可怕。据中国青年报4月6日报道,中国的抑郁症患者约有9000万人,其中只有三分之一的人就诊而拥有病历记录。患者人数每年还以10%的速度增加。

5-羟色胺的转运体蛋白(SERT,serotonin transporter)是目前抗抑郁症常用药物的靶点(如果把药物比做一支箭,靶点就是药物发挥其治疗作用所需要射中的物质)之一。当该蛋白的活性被抑制时,患者大脑神经突触中的5-羟色胺水平会升高,患者的抑郁、焦虑症状常常会改善。
但SERT蛋白的分子结构一直不被人类知晓,人们也不清楚相关药物的作用机理。
4月7日,《自然》在线发表论文《人5-羟色胺转运体蛋白的X射线结构和作用机制》(X-ray structures and mechanism of the human serotonin transporter),首次报道了人SERT蛋白的分子结构,其分辨率高达3.15埃(1埃等于10^(-10)米)。
该研究由美国霍华德休斯医学研究所(HHMI)研究员埃里克·古奥(Eric Gouaux)带领的研究小组完成。
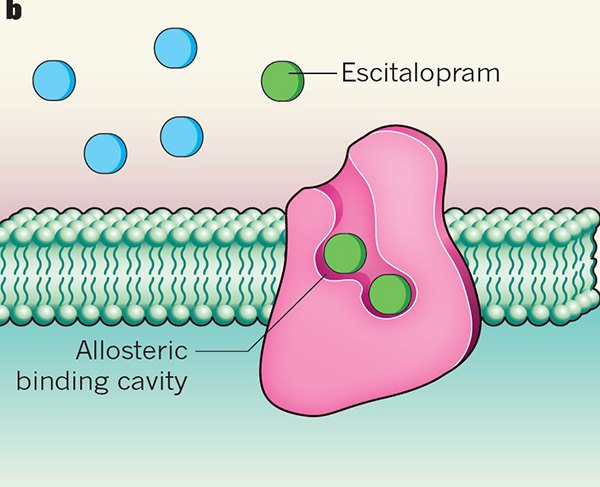
S-西酞普兰(S-citalopram)和帕罗西汀(paroxetine)是目前临床治疗中常用的两种抗抑郁症药物。研究人员首次看到,这两种药物都能竞争性地结合在SERT蛋白的“活性中心”——底物结合位点上,直接阻断5-羟色胺与该蛋白的结合,抑制了该蛋白的活性。
此外,研究人员还首次证实了一个长达31年的预言。
1985年,佩尔·普兰格(Per Plenge) 和埃尔林· 梅勒鲁普(Erling T. Mellerup)发表论文提出,SERT蛋白除了有底物结合位点,还存在一个变构位点。当该变构位点被占据时,SERT蛋白的活性被改变,它被激活或抑制。
埃里克·古奥带领的研究小组通过X射线晶体衍射技术,首次看到了SERT蛋白的这一变构位点。
他们发现,S-西酞普兰除了能结合在SERT蛋白的活性中心上,还能松散地结合在SERT蛋白的变构位点上,将该蛋白锁定在“向外打开”状。但帕罗西汀只能结合在SERT蛋白的活性中心上。
这解释了为什么药物S-西酞普兰能在临床治疗中有更好的表现。
埃里克·古奥等人在论文中预测,人们未来可能会发现一系列小分子化合物,通过结合SERT蛋白的变构位点,来激活或抑制SERT的活性。
此前,2005和2013年时,埃里克·古奥带领的研究团队还先后解析了细菌类SERT蛋白LeuT和果蝇的同类蛋白dDAT的分子结构。
研究小组发现,在活性中心上,人SERT蛋白和果蝇的同类蛋白在结构上高度“雷同”,但在变构位点上,二者完全不同。
《自然》同时发表美国杜克大学医学中心教授马克·卡洛(Marc G. Caron)和哥本哈根大学教授乌尔里克·格瑟(Ulrik Gether)针对这一发现撰写的评论文章。
他们认为,埃里克·古奥等人首次发现的SERT详细的分子结构,尤其是其变构位点的发现,为帮助人们开发出更具特异性和更有治疗效果的抗抑郁症等疾病的药物,提供了无与伦比的机会。而膜蛋白拥有变构位点,可能是超乎人们想象的普遍现象。目前人们已经确定变构位点结构的神经递质受体,已经超过24个,部分已经开发成治疗疾病的药物。
他们同样解释了,为什么SERT蛋白分子结构的解析是困难的。首先,X射线晶体衍射需要大量的纯度很高的蛋白,其次,SERT蛋白是一个巨大的膜蛋白,它拥有600多个氨基酸残基,12次穿过细胞膜。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




