- +1
NEJM翻译+述评 | 瑞德西韦同情治疗重症新冠肺炎,68%临床获益,评价疗效尚早
“NEJM医学前沿”授权转载
北京时间4月11日凌晨3点,《新英格兰医学杂志》(NEJM)在线发表瑞德西韦同情用药的回顾性分析结果。在纳入分析的53例来自美国、日本、加拿大和欧洲(意大利、法国、荷兰)的重症新冠肺炎患者中,68%的患者在氧气支持类型方面得到改善,有创通气患者的死亡率降至18%。
该研究结果是瑞德西韦同情用药项目中截至目前的最高质量数据。当然,本研究缺乏对照组,作者因此在摘要中强调,评估疗效需要等待仍在进行的随机、安慰剂对照临床试验的结果。中国主导的两项试验将在4月27日结束,其他试验结果也将陆续出炉。让我们满怀希望,拭目以待。
NEJM医学前沿在此发表该文的官方全文翻译,这是新冠肺炎疫情暴发以来我们发表的第29篇中文全文翻译。

瑞德西韦同情用药治疗重症Covid-19患者
Compassionate Use of Remdesivir for Patients with Severe Covid-19
DOI: 10.1056/NEJMoa2007016
摘 要
背景
瑞德西韦是一种核苷类似物前体药物,能够抑制病毒RNA聚合酶,体外试验显示出抗SARS-CoV-2的活性。
方法
我们以同情用药的方式向住院接受治疗的Covid-19患者(由SARS-CoV-2感染引起)提供了瑞德西韦。患者为SARS-CoV-2感染的确诊患者,他们在呼吸环境空气时的氧饱和度为≤94%或接受氧气支持。患者接受瑞德西韦治疗10天,方案为第1天静脉给药200 mg,在随后9天中每天给药100 mg。本文是基于以下患者队列的数据:2020年1月25日至2020年3月7日期间接受瑞德西韦治疗并且至少有随后1天的临床数据。
结果
61例患者接受了至少一次瑞德西韦治疗,其中8例患者的数据无法分析(7例患者缺乏治疗后的数据,1例患者给药错误)。53例患者的数据可供分析,其中美国22例患者,欧洲或加拿大22例,日本9例。基线时,30例患者(57%)正在接受机械通气治疗,4例(8%)正在接受体外膜氧合。中位随访时间为18天,在此期间有36例患者(68%)的氧气支持分级有所改善;其中,机械通气支持的30例患者中,17例(57%)拔除气管插管。共计25例患者(47%)出院,7例患者(13%)死亡;在接受有创通气的患者中,死亡率为18%(34例患者中死亡6例),而未接受有创通气的患者死亡率为5%(19例患者中死亡1例)。
结论
在因重症Covid-19住院治疗并接受瑞德西韦同情用药的53例患者队列中,36例(68%)观察到临床获益。疗效判断有待于目前正在实施的瑞德西韦的随机、安慰剂对照试验的结果。(由吉利德科学公司资助。)
自2019年12月报告最早的病例以来,严重急性呼吸综合征冠状病毒2(SARS-CoV-2)感染已发展成世界性大流行[1,2]。SARS-CoV-2所致疾病Covid-19正在压倒全球医疗系统[3,4]。SARS-CoV-2感染的症状多样,从无症状到肺炎,再到急性呼吸窘迫综合征和多系统器官衰竭等危及生命的并发症,最后再到死亡[5-7]。老年患者和之前有呼吸系统或心血管疾病的患者出现严重并发症的风险最高[6,7]。
在尚无已经证实的有效疗法的情况下,目前的治疗方案采用有创和无创氧气支持及抗生素等支持性治疗[8,9]。此外,许多患者接受了超说明书范围用药或同情用药,包括抗逆转录病毒药、抗寄生虫药、抗炎药和恢复期血浆[10-13]。
瑞德西韦是一种核苷类似物的前体药物,可在细胞内代谢生成对病毒RNA聚合酶具有抑制作用的三磷酸腺苷类似物。瑞德西韦对几个病毒科具有广谱抗病毒活性,包括丝状病毒(如埃博拉病毒)和冠状病毒(如SARS-CoV 和中东呼吸综合征冠状病毒[MERS-CoV]),并在这些冠状病毒的非临床模型中显示出预防和治疗效果[14-17]。
体外试验也显示瑞德西韦对SARS-CoV-2具有抗病毒活性。根据在约500人中获得的经验(包括健康志愿者和埃博拉病毒急性感染患者[18,19]),瑞德西韦似乎具有良好的临床安全性,而且我们的数据也支持这一点(数据已提交并与世界卫生组织[WHO]共享)。我们在本文中报告了因重症Covid-19住院并接受瑞德西韦同情用药的一个患者队列的结局。
方法
患者
吉利德科学公司从2020年1月25日开始接受临床医师提交的瑞德西韦同情用药申请。临床医师在提交申请时需填写患者的人口统计学和疾病状况评估表(见补充附录,补充附录与本文全文可在NEJM.org获取)。吉利德公司批准了符合以下条件的申请:逆转录酶聚合酶链反应确诊为SARS-CoV-2感染,并且在呼吸环境空气时氧饱和度≤94%或需要氧气支持的住院患者。此外还要求患者的肌酐清除率>30 mL/min,血清丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)<正常范围上限的5倍,并且须同意不使用Covid-19的其他试验性药物。
对于获得批准的病例,计划的治疗方案是瑞德西韦10日疗程,包括第1日的200 mg负荷剂量静脉给药,及之后9日的每日100 mg给药。支持性治疗由临床医师自行决定。随访将持续至瑞德西韦治疗开始后至少28天,或者持续至患者出院或死亡。本文报告了截至2020年3月30日所收集的数据。此类开放标签项目并无预先确定的患者数量、研究中心数量和持续时间。此项分析中包含的一些患者的数据之前已经发布[20-22]。关于研究设计和实施的详细信息参见研究方案(可在NEJM.org获取)。
研究评估
从第1日至第10日,本试验每日报告患者的氧气支持需求、不良事件和实验室数值(包括血清肌酐、ALT和AST),并主动收集截至第28日的随访数据。尽管本项目并无预设的终点,但我们定量了重要临床事件的发生率,包括氧气支持需求(环境空气、低流量氧疗、经鼻导管高流量氧疗、无创正压通气[NIPPV]、有创机械通气和体外膜氧合[ECMO])的变化、出院和报告的不良事件(包括导致停药的不良事件、严重不良事件和死亡)。
此外,我们还评估了临床改善的患者比例,改善的定义为出院、修订版等级量表评分与基线相比降低至少2分(WHO研发蓝图专家组[WHO R&D Blueprint Group]的建议)或同时符合上述两条。6分量表如下:1. 未住院;2. 住院治疗,不需要吸氧;3. 住院治疗,需要吸氧;4. 住院治疗,需要经鼻导管高流量氧疗、无创机械通气或这两者;5. 住院治疗,需要有创机械通气、ECMO或这两者;6. 死亡。
试验项目监管
我们对每例患者所做的瑞德西韦治疗均获得了监管机构及机构审查委员会或独立伦理委员会的批准,并依照当地法规获得了所有患者的同意。本试验项目由申办方(吉利德科学公司)设计和根据试验方案实施。申办方收集了数据,监察了项目的实施并进行了统计学分析。所有作者均可查看数据,并负责所报告数据的完整性和准确性。论文初稿由吉利德科学公司雇佣的一名写作者和本文的一名作者撰写,所有作者均提出了建议。
统计学方法
本试验未进行样本量计算。分析人群包括在2020年3月7日当日或之前接受了首剂瑞德西韦治疗,并且获得了之后至少一天的临床数据的所有患者。我们使用Kaplan-Meier分析方法描述了瑞德西韦同情用药队列的临床改善情况和死亡率。采用Cox比例风险回归方法评估了治疗前的特征与结局之间的关联。因为分析中未规定对基线变量与结局之间的关联检验进行多重比较校正,因此我们将结果报告为点估计值和95%置信区间。置信区间宽度未进行多重比较校正,因此置信区间不能用于推断与结局之间的明确关联。所有分析均采用SAS软件9.4版完成(SAS Institute)。
结果
患者随机分组
共计61例患者在2020年3月7日当日或之前接受了至少一次瑞德西韦治疗;其中8例患者由于基线后信息缺失(7例)或瑞德西韦开始给药时间错误(1例)而被排除(补充附录图S1)。本分析纳入剩余的53例患者,其中40例(75%)完成了瑞德昔韦的整个疗程(10天),10例(19%)接受了5-9天的治疗,有3例(6%)的治疗不足5天 。
患者基线特征
表1列出了接受同情用药的53例患者队列的基线人口统计学和临床特征。患者的入组国别包括美国(22例患者)、日本(9例)、意大利(12例)、奥地利(1例)、法国(4例)、德国(2例)、荷兰(1例)、西班牙(1例)和加拿大(1例)。总共40例患者(75%)为男性,年龄范围为23~82岁,中位年龄为64岁(四分位距,48-71)。基线时,大多数患者(34例患者 [64%])接受有创通气治疗,其中30例(57%)接受机械通气,4例(8%)接受ECMO。在瑞德西韦治疗开始之前,有创机械通气治疗的中位时间为2天(四分位距,1-8)。与基线时接受无创氧气支持的患者相比,接受有创通气的患者往往年龄较大(中位年龄,53岁 vs. 67岁),是男性的可能性较大(68% vs. 79%),血清ALT中位值(27 U/L vs. 48 U/L)和肌酐中位值(0.79 mg/dl vs. 0.90 mg/dl [69.8 μmol/L vs. 79.6 μmol/L])较高,而且合并症患病率较高,包括高血压(21% vs. 26%)、糖尿病(5% vs. 24%)、高脂血症(0% vs. 18%)和哮喘(5% vs. 15%)。在瑞德西韦治疗开始之前,症状持续的中位时间为12天(四分位距,9-15),接受有创通气的患者与接受无创通气的患者之间无显著差异(表1)。
表1. 患者的基线人口统计学特征和临床特征*
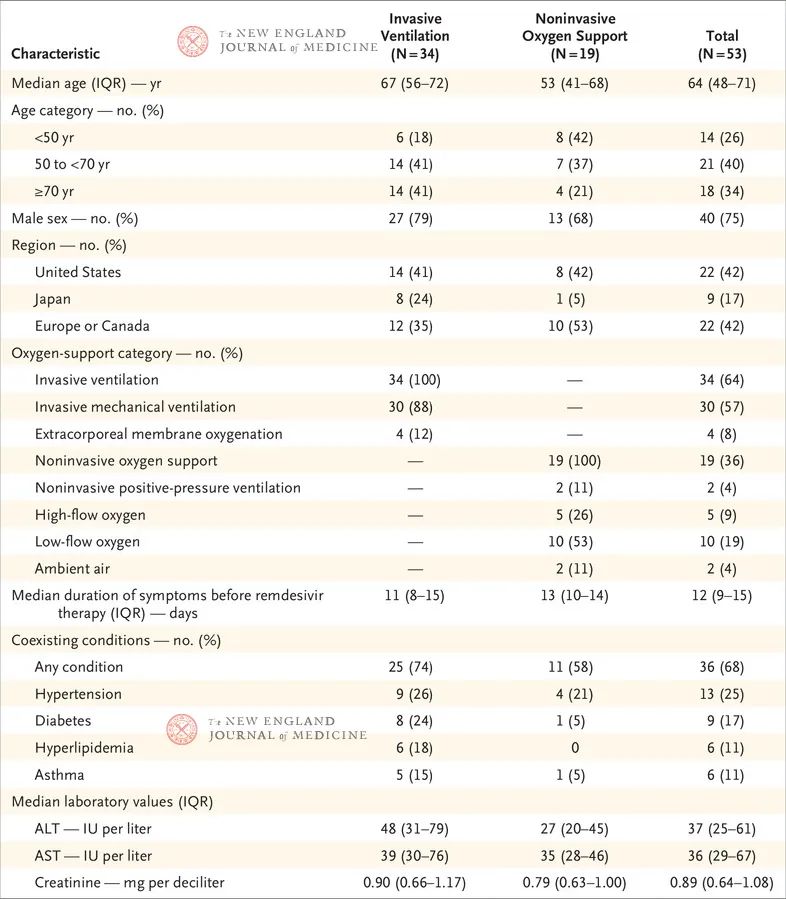
* ALT表示丙氨酸转氨酶,AST表示天冬氨酸转氨酶,IQR表示四分位距。* 将肌酐数值转换为mmol/L需乘以88.4。
瑞德西韦治疗期间临床改善情况
在瑞德西韦首次给药后的18天中位随访期内(四分位距,13-23),在53例患者中,36例(68%)的氧气支持级别有所改善,8例(15%)出现恶化(图1)。呼吸环境空气或低流量吸氧的所有12例患者均有所改善;此外在接受无创氧气支持(NIPPV或高流量吸氧)的7例患者中,有5例(71%)有所改善。值得注意的是,接受有创机械通气的30例患者中有17例(57%)拔除气管插管,接受ECMO的4例患者中有3例(75%)停止ECMO支持;且最后一次随访时全部存活。图2显示了各患者的氧气支持级别的变化情况。截至最近一次随访时,53例患者中有25例(47%)已出院(其中接受有创通气支持的患者的出院比例为24%[34例患者中的8例],接受无创氧气支持患者的出院比例为89%[19例患者中的17例])。
临床改善的定义为患者的6分等级量表评分下降2分及2分以上或者顺利出院;截至28天随访期,通过Kaplan–Meier分析得出临床改善的累积发生率是84%(95%置信区间[CI],70-99)(图3A)。有创通气患者的临床改善发生率低于无创通气患者(临床改善的风险比,0.33;95% CI,0.16-0.68),而且70岁及以上患者的临床改善发生率也较低(与50岁以下患者相比的风险比,0.29;95% CI,0.11-0.74)(图3C)。患者的性别、入组地域、合并症和瑞德西韦治疗开始之前的症状持续时间与临床改善无显著相关性(表S1)。
死亡率
53例患者中,有7例(13%)在完成瑞姆昔韦治疗后死亡,其中包括6例接受有创通气的患者(在接受有创通气的34例患者中占比18%),以及1例接受无创氧气支持的患者(在接受无创氧气支持的19例患者中占比5%)(有关病例概况请参见补充附录)。从开始瑞德西韦治疗至死亡的中位间隔时间为15天(四分位距,9-17)。自入院之日起统计,总死亡率是0.56/100住院日(95% CI,0.14-0.97),接受有创通气的患者(0.57/100住院日,95% CI,0-1.2])与接受无创通气的患者(0.51/100住院日;95% CI,0.07-1.1])之间没有显著性差异。
70岁或以上患者的死亡风险较高(与70岁以下的患者相比,风险比为11.34;95% CI为1.36-94.17);基线时血清肌酐较高的患者死亡风险也较高(每mg/dl的风险比为1.91;95% CI:1.22-2.99)。与接受无创氧气支持的患者相比,接受有创通气的患者的死亡风险比为2.78(95% CI,0.33-23.19)(表S2)。

图1. 基线和治疗后的氧气支持状态。
对于各个氧气支持级别,均以基线时的患者人数为分母来计算百分比。我们以不同颜色显示不同的氧气支持状态:改善(蓝色方格)、无变化(浅灰色)以及恶化(灰色)。有创通气包括有创机械通气、体外膜氧合(ECMO)或这两者。无创通气包括经鼻导管高流量氧疗,无创正压通气(NIPPV)或这两者。
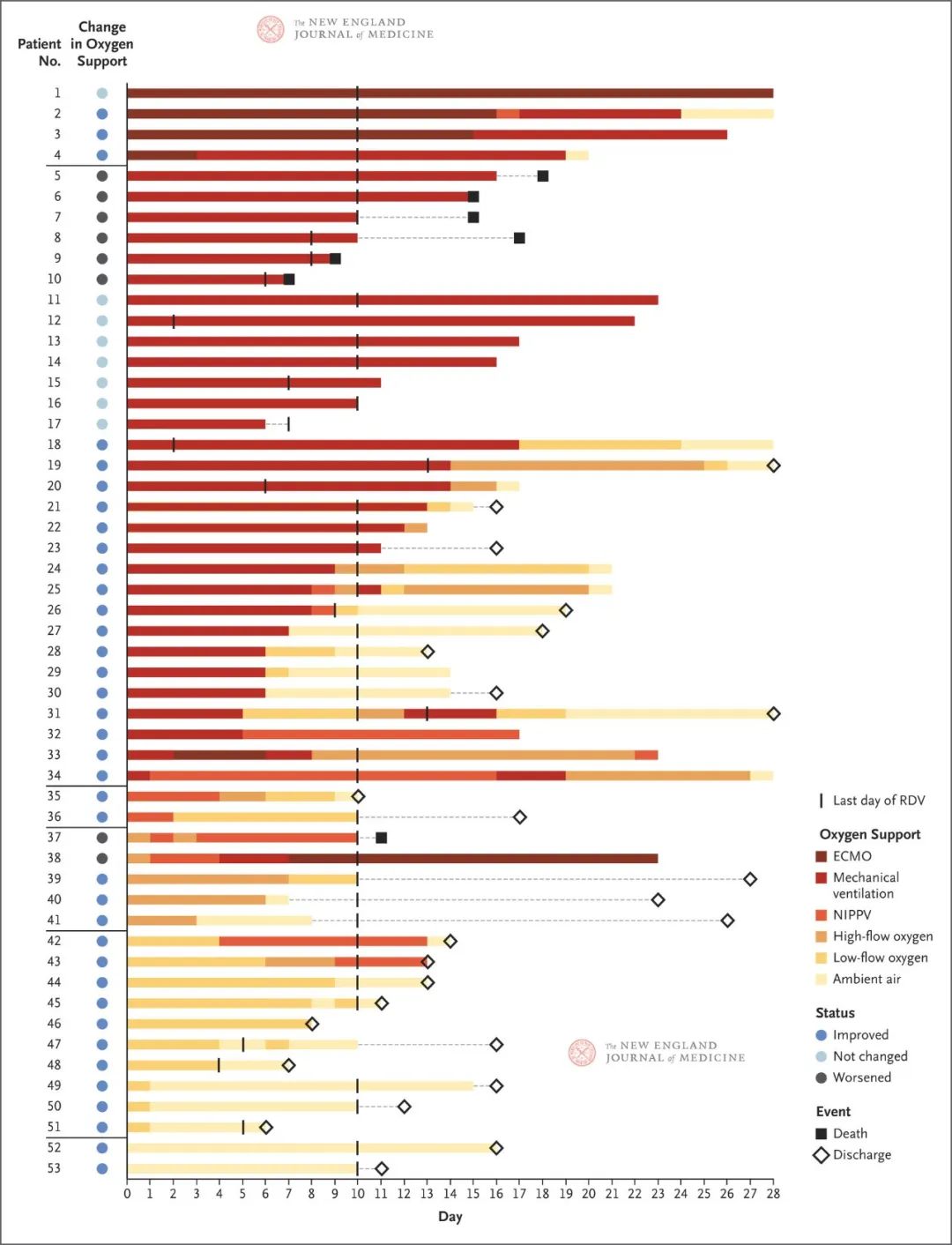
图2. 各患者的氧气支持状态较基线的变化。
基线(第0天)是指开始接受瑞德西韦(RDV)治疗的日期。最终氧气支持状态是基于最新报告的数据加以判断。对于每例患者,该行中的颜色表示该患者的氧气支持状态随时间推移而变化情况。每行左侧的彩色圆圈表示患者的氧气支持状态与基线相比的总体变化。如果在最后一次随访之前患者的氧气支持状态有所改善或患者出院,则该患者的状态判定为“改善”。黑色竖线表示RDV治疗的最后一天。灰色虚线表示从患者最近一次报告氧气状态至事件发生时(死亡或出院)或RDV最后一次给药之间的数据缺失。行尾的实心正方形表示患者死亡;空心菱形表明患者已出院。如果行尾没有正方形或菱形,则患者既未死亡也未出院。患者2截至第36天一直在呼吸环境空气。患者19和31在第44天出院。
安全性
随访期间共有32例患者(60%)报告了不良事件(表2)。最常见的不良事件包括肝酶升高、腹泻、皮疹、肾功能损害和低血压。一般而言,接受有创通气的患者中不良事件更为常见。共有12例患者(23%)出现严重不良事件。最常见的严重不良事件(包括多器官功能障碍综合症、感染性休克、急性肾损伤和低血压)发生于基线时接受有创通气的患者。
4例患者(8%)提前终止了瑞地昔韦治疗:1例由于之前合并的肾功能衰竭加重,1例由于多器官功能衰竭,2例由于转氨酶升高,其中1例出现斑丘疹。
实验室检查数据
考虑到该同情用药项目的性质,我们仅收集了数量有限的实验室检测数据。在随访期间,血清ALT、AST和肌酐的中位值有波动(图S2)。

图3. 从基线至第36天的临床改善的累积发生率。
我们分别列出了整个队列、根据基线通气状态进行分层的队列以及根据年龄分层的队列的改善情况。
表2. 不良事件总结
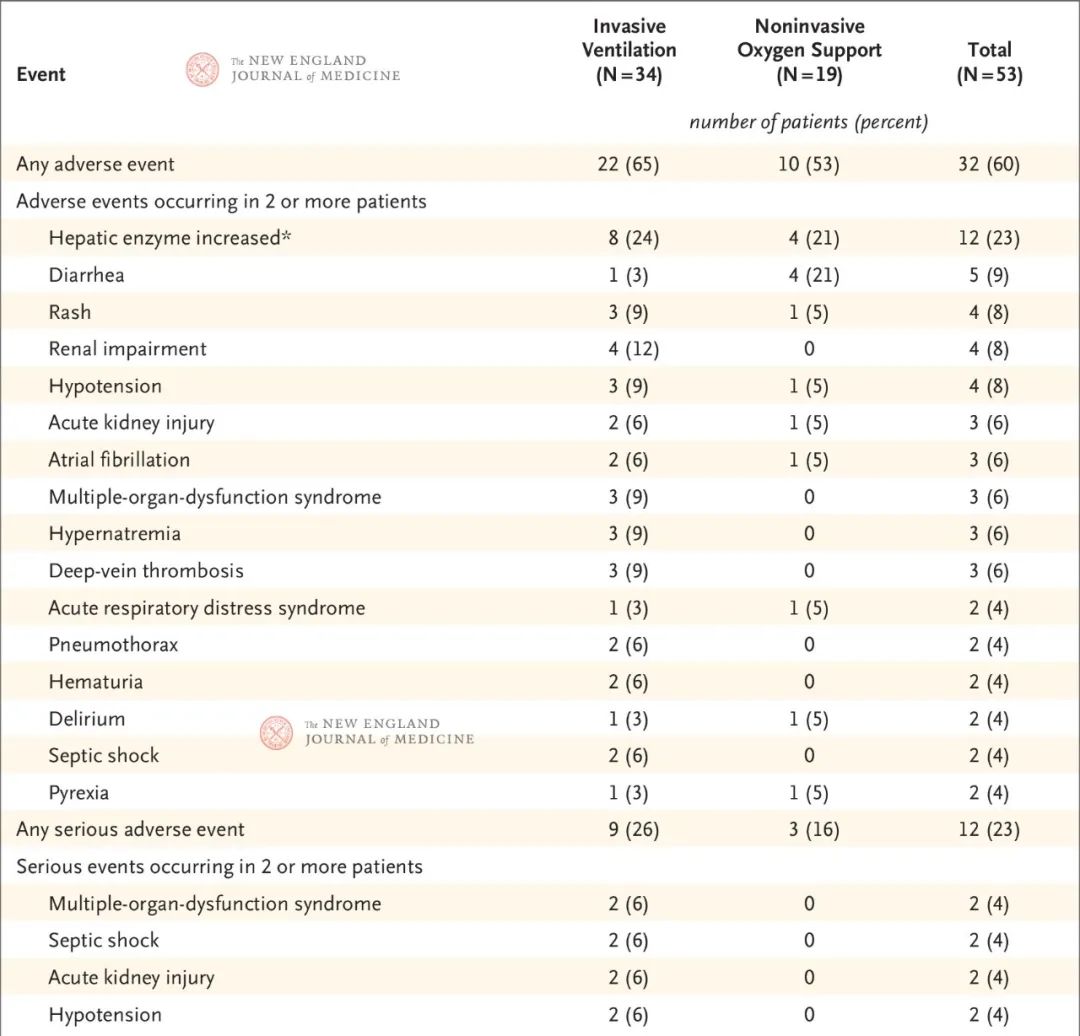
*不良事件的术语根据《药事管理标准医学术语集》(Medical Dictionary for Regulatory Activities)第22.1版制定。肝酶升高包括以下术语:肝酶升高、丙氨酸转氨酶升高、天冬氨酸转氨酶升高和转氨酶升高。2例患者因肝酶升高而停止瑞德西韦治疗。
讨论
迄今为止尚无证实对Covid-19患者有效的治疗方法。这份初步报告描述了接受瑞德西韦治疗的一个人数较少的Covid-19重症患者队列的临床结局。目前有几项正在进行中的瑞德西韦治疗Covid-19的随机对照试验,这些试验的数据很快将提供关于其安全性和疗效的更详实证据,而这一同情用药项目中观察到的结局是截至目前的最高质量数据。
具体而言,68%患者的氧气支持分级有所改善,中位18天随访期间的总死亡率为13%。在近期一项洛匹那韦-利托那韦治疗Covid-19住院患者的随机对照试验中,28天死亡率为22% [10]。需要指出的是,在上述试验的199例患者中,基线时只有1例接受有创通气。在主要来自中国的病例系列和队列研究中,报告的重症病例死亡率为17%~78%,重症病例的定义为需要送入重症监护病房、需要有创通气或同时需要这两者[23-28]。例如在中国武汉的201例住院患者中,总死亡率为22%,在接受有创机械通气的患者中,死亡率为66%(44/67)[7]。
相比之下,考虑到本项目中患者人群的疾病严重程度,这一瑞德西韦同情用药队列中13%的死亡率引人关注;但本项目纳入的患者与其他论文中研究的患者不具有直接可比性。例如在本项目的瑞德西韦治疗患者中,有64%在基线时接受有创通气(包括8%接受ECMO治疗的患者),而该亚组的死亡率为18%(与之相比,接受无创氧气支持的患者的死亡率为5.3%),且大多数患者(75%)为男性,年龄超过60岁,并有合并症。
遗憾的是,我们的同情用药项目未收集用于证实瑞德西韦抗病毒效果以及基线病毒载量与病毒抑制作用及临床应答(如果有的话)之间关联的病毒载量数据。此外,在本研究中,瑞德西韦治疗的持续时间并不完全一致,主要原因是临床状况改善后患者出院。目前进行中的随机试验正在评估较短疗程(例如5天,而非本研究中的10天)的效果,从而可以让更多患者在大流行期间得到治疗。
在同情用药队列接受瑞德西韦短期治疗期间,我们未发现新的安全性信号。非临床毒理学研究显示了肾脏异常,但未观察到瑞德西韦导致肾毒性的明确证据。与在健康志愿者和埃博拉病毒感染患者研究中观察到的情况相同,我们在Covid-19重症患者队列中观察到ALT、AST或这两项指标轻度至中度升高[18,19]。然而,考虑到Covid-19患者的肝功能障碍发生率,我们难以将肝毒性归因于瑞德西韦或基础疾病[29]。瑞德西韦用于Covid-19患者的安全性和副作用需经过安慰剂对照试验的评估。
对本研究结果的解读受到以下因素的限制:队列规模小、随访时间相对短、可能有本项目性质所造成的缺失数据、在最初治疗的患者中有8例的信息缺失以及缺少随机对照组。虽然最后一项导致我们无法得出明确结论,但与文献中的同期队列(预期其综合治疗与我们的队列一致)所做的比较提示瑞德西韦对Covid-19重症患者可能有临床益处。但也可能有其他因素导致了结局差异,包括支持性治疗的类型(例如合并用药或通气操作的差异)以及医疗机构治疗方案和住院标准的差异。此外,将有创通气作为疾病严重程度的替代指标可能受到特定机构可供使用的呼吸机数量的影响。这些非对照数据的结果将为正在进行中的瑞德西韦治疗Covid-19的随机、安慰剂对照试验提供信息。
参考文献
1. Cucinotta D, Vanelli M. WHO declares COVID-19 a pandemic. Acta Biomed 2020;91:157-160.
2. Spinelli A, Pellino G. COVID-19 pandemic: perspectives on an unfolding crisis. Br J Surg 2020 March 19 (Epub ahead of print).
3. Fauci AS, Lane HC, Redfield RR. Covid-19 — navigating the uncharted. N Engl J Med 2020;382:1268-1269.
4. Mahase E, Kmietowicz Z. Covid-19: doctors are told not to perform CPR on patients in cardiac arrest. BMJ 2020;368:m1282-m1282.
5. Rodriguez-Morales AJ, Cardona-Ospina JA, Gutiérrez-Ocampo E, et al. Clinical, laboratory and imaging features of COVID-19: a systematic review and meta-analysis. Travel Med Infect Dis 2020 March 13 (Epub ahead of print).
6. Weiss P, Murdoch DR. Clinical course and mortality risk of severe COVID-19. Lancet 2020;395:1014-1015.
7. Wu C, Chen X, Cai Y, et al. Risk factors associated with acute respiratory distress syndrome and death in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med 2020 March 13 (Epub ahead of print).
8. Onder G, Rezza G, Brusaferro S. Case-fatality rate and characteristics of patients dying in relation to COVID-19 in Italy. JAMA 2020 March 23 (Epub ahead of print).
9. Poston JT, Patel BK, Davis AM. Management of critically ill adults with COVID-19. JAMA 2020 March 26 (Epub ahead of print).
10. Cao B, Wang Y, Wen D, et al. A trial of lopinavir–ritonavir in adults hospitalized with severe Covid-19. N Engl J Med. DOI: 10.1056/NEJMoa2001282.
11. Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA 2020 March 27 (Epub ahead of print).
12. Touret F, de Lamballerie X. Of chloroquine and COVID-19. Antiviral Res 2020 March 5 (Epub ahead of print).
13. Baden LR, Rubin EJ. Covid-19 — the search for effective therapy. N Engl J Med. DOI: 10.1056/NEJMe2005477.
14. de Wit E, Feldmann F, Cronin J, et al. Prophylactic and therapeutic remdesivir (GS-5734) treatment in the rhesus macaque model of MERS-CoV infection. Proc Natl Acad Sci U S A 2020;117:6771-6776.
15. Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses. Sci Transl Med 2017;9(396):eaal3653-eaal3653.
16. Sheahan TP, Sims AC, Leist SR, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun 2020;11:222-222.
17. Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res 2020;30:269-271.
18. Mulangu S, Dodd LE, Davey RT Jr, et al. A randomized, controlled trial of Ebola virus disease therapeutics. N Engl J Med 2019;381:2293-2303.
19. European Medicines Agency. Summary on compassionate use: Remdesivir Gilead. April 3, 2020 (https://www.ema.europa.eu/en/documents/other/summary-compassionate-use-remdesivir-gilead_en.pdf. opens in new tab).
20. Kujawski SA, Wong KK, Collins JP, et al. First 12 patients with coronavirus disease 2019 (COVID-19) in the United States. medRxiv, March 12, 2020 (https://www.medrxiv.org/content/10.1101/2020.03.09.20032896v1. opens in new tab).
21. Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States. N Engl J Med 2020;382:929-936.
22. Lescure FX, Bouadma L, Nguyen D, et al. Clinical and virological data of the first cases of COVID-19 in Europe: a case series. Lancet Infect Dis 2020 March 27 (Epub ahead of print).
23. Arentz M, Yim E, Klaff L, et al. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington State. JAMA 2020 March 19 (Epub ahead of print).
24. Wang D, Hu B, Hu C, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus-infected pneumonia in Wuhan, China. JAMA 2020 February 7 (Epub ahead of print).
25. Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020 February 24 (Epub ahead of print).
26. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet 2020;395:1054-1062.
27. Bhatraju PK, Ghassemieh BJ, Nichols M, et al. Covid-19 in critically ill patients in the Seattle region — case series. N Engl J Med. DOI: 10.1056/NEJMoa2004500.
28. ICNARC report on COVID-19 in critical care. London: Intensive Care National Audit & Research Centre, March 27, 2020 (https://www.icnarc.org/DataServices/Attachments/Download/b5f59585-5870-ea11-9124-00505601089b. opens in new tab).
29. Zhang C, Shi L, Wang FS. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol Hepatol 2020 March 4 (Epub ahead of print).
版权信息
本文由《NEJM医学前沿》编辑部负责翻译、编写或约稿。对于源自NEJM集团旗下英文产品的翻译和编写文章,内容请以英文原版为准。中译全文以及所含图表等,由马萨诸塞州医学会NEJM集团独家授权。未经授权的翻译是侵权行为,版权方保留追究法律责任的权利。
原标题:《NEJM翻译+述评|瑞德西韦同情治疗重症新冠肺炎,68%临床获益,评价疗效尚早》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




