- +1
疯狂拉扯你皮肤老化进度条的“三兄弟”——氧化、炎症、糖化
原创 果熊 时光派 来自专辑面部抗衰

关注皮肤衰老与面部年轻化
活着就是当旬期
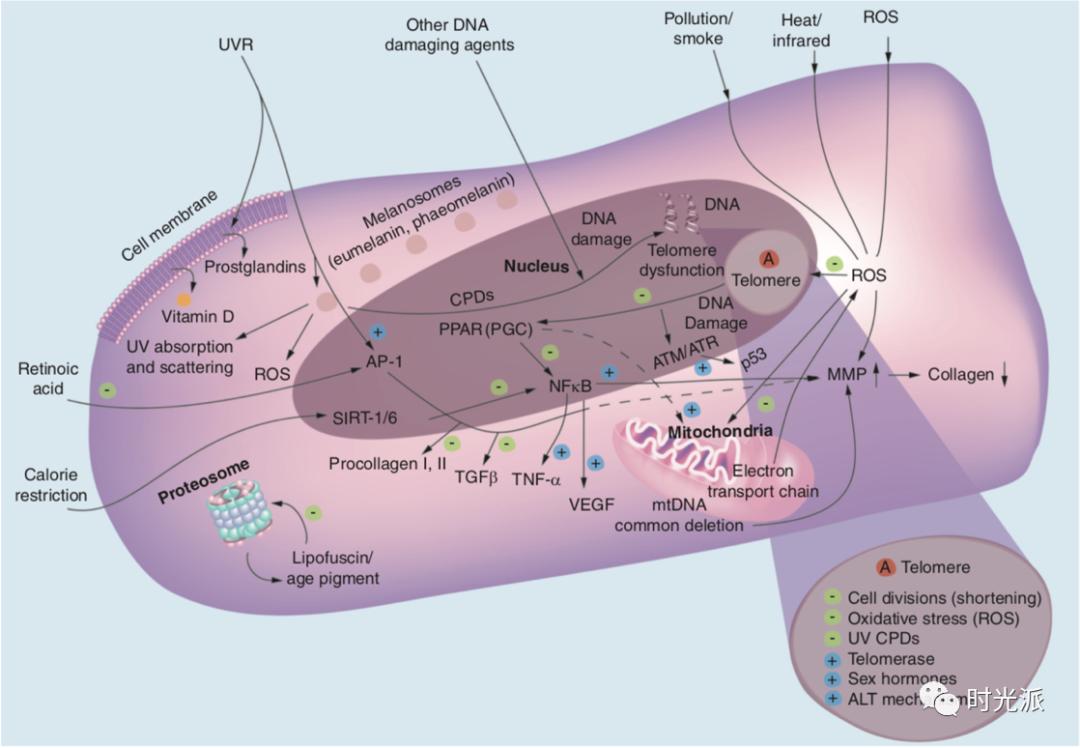
上期我们介绍了皮肤老化背后的细胞学机制,现在我们就更进一层,聊聊其背后的分子机制。皮肤老化分子机制中,影响最大、程度最深的就是三位一体夺走你美颜的:氧化、炎症和糖化。
氧化应激
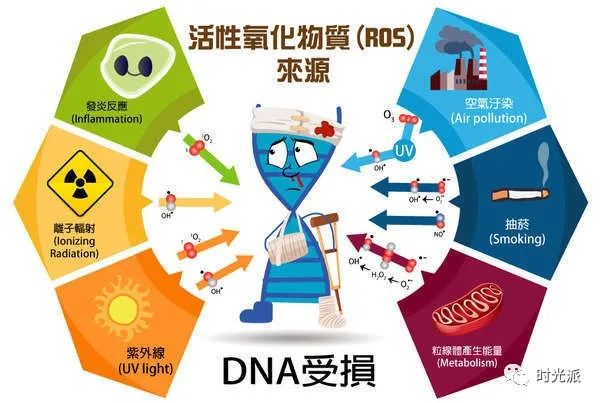
在新陈代谢过程中,细胞会产生大量活性氧(ROS)。不论内源性老化还是光老化,活性氧(ROS)都在你皮肤老化的过程中发挥着巨大的作用。ROS对皮肤的影响主要有以下三点:
直接损伤遗传物质和蛋白质
活性氧在细胞内可谓“无恶不作”,可引起DNA碱基改变、DNA断裂、染色体易位、DNA-蛋白质交联、蛋白质构象改变等变化【1】。从而引起基因损伤,或是使蛋白质失活等,导致皮肤老化。
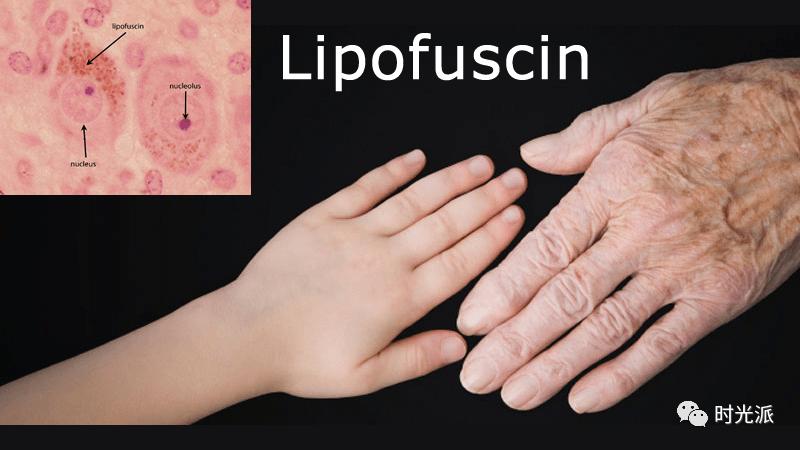
细胞膜和细胞器的脂膜被ROS过氧化之后,经溶酶体消化之后,形成脂褐素(lipofuscin),脂褐素的积累随年龄增长而增多,所以又被叫作“衰老色素”。脂褐素在细胞内堆积可影响细胞的结构、功能和代谢【2】。脂褐素沉积在皮肤内,引起我们常见的“老年斑”【3】。
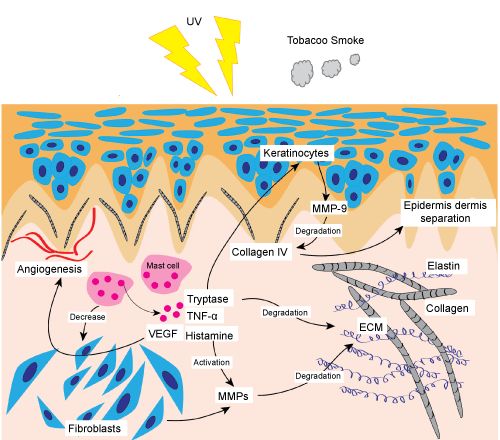
我们经常形容“小鲜肉”、“小仙女”们的脸上“满满胶原蛋白”。而导致我们年轻时满脸胶原蛋白随着年龄流失的元凶就是ROS。

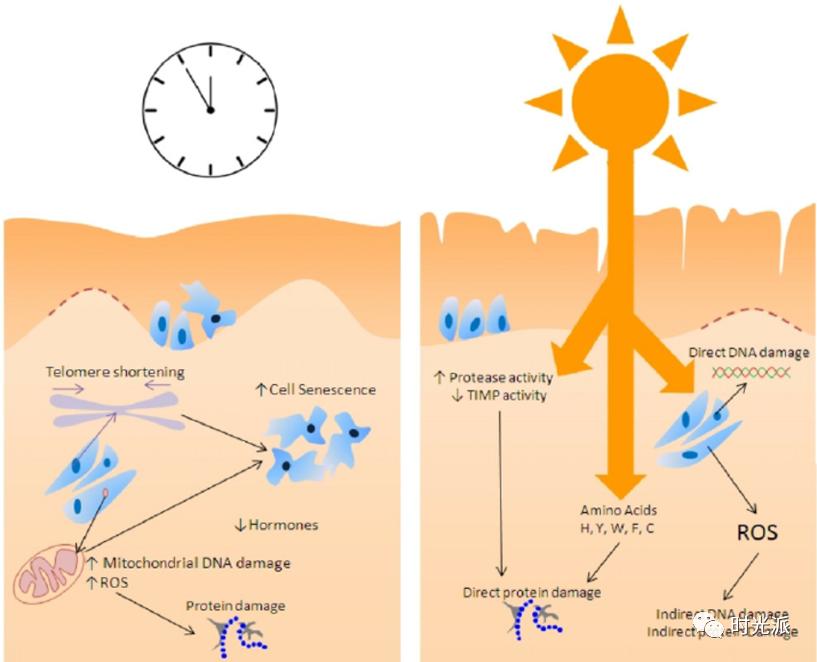
来了来了,又是老读者们熟悉的“白眼狼”—慢性炎症。在皮肤衰老的过程中,慢性炎症这头“白眼狼”也逃不脱干系。
皮肤里的慢性炎症性衰老和咱们平时理解的痘痘(痤疮)、皮炎之类的炎症不大一样,这一机制最初是在21世纪初,“炎性衰老”概念被提出之后,才得到皮肤科医生们的重视,将其特征描述为可控、低度、慢性、系统性、无症状【6】。翻译成人话呢,就是说这个炎症平时很低调,不会出现啥表现,但是就是无处不在,然后暗戳戳地就让你变老了。
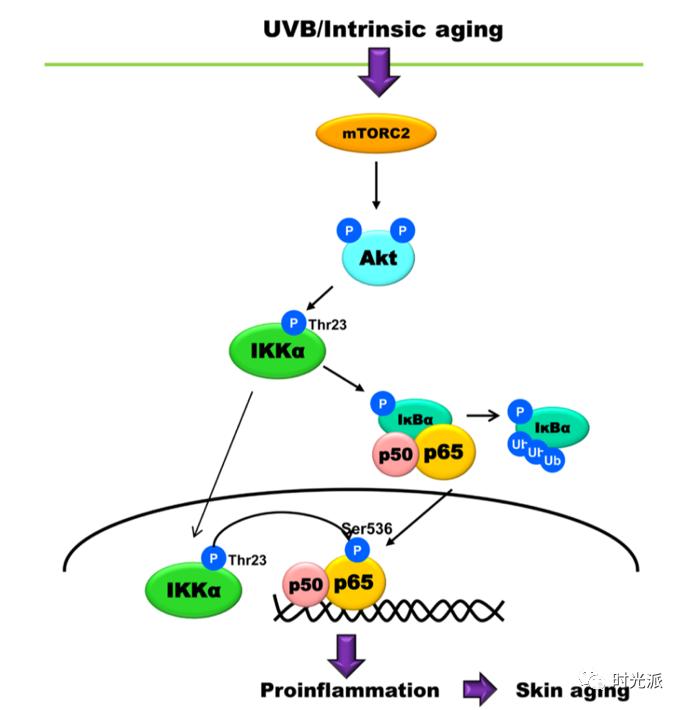
氧化应激过程可以激活NF-κB等炎症通路,促进慢性炎症的发生,慢性炎症又会更进一步加速氧化应激的进程【7,8】。慢性炎症和氧化应激就是这样狼狈为奸,共同把你往皱纹松弛的深渊推。




激素水平降低
作为人体最大的器官,皮肤的衰老也和其他器官的老化一样受到年龄增长、激素自然分泌减少的影响,主要包括垂体、肾上腺、性腺的激素分泌减少。
有研究证实,性激素通过作用于TERT基因来增加端粒酶(telomerase)的活性【16】,端粒酶可以延长我们因为细胞分裂而缩短的端粒的长度。这与上一期提到皮肤细胞随年龄减少的细胞学机制息息相关。(延伸阅读:诺奖盖章的黑科技端粒酶,究竟能不能帮助我们实现永生?)


遗传(内源性)和环境(外源性)因素都会导致皮肤老化的基因表型变化,细胞核内的基因组DNA和线粒体DNA(mtDNA)受到的损伤以及随后发生的DNA修复在皮肤衰老相关的变化以及皮肤癌变中扮演着很重要的角色【18】。
[1] Kavitha K Reddy, Barbara A Gilchrest. The molecular basis of cutaneous aging. Dermatology. 6(5): 525–536 (2011).
[2] Ulf T Brunk, Alexei Terman. Lipofuscin: mechanisms of age-related accumulation and influence on cell function. Free Radical Biology and Medicine. Volume 33, Issue 5, 1 September 2002, Pages 611-619.
[3] 丁克详. 皮肤老年斑(脂褐素)的生物学特征及形成机制. 第八届东南亚地区医学美容学术大会论文汇编(2004).
[4] Fu X, Parks WC, Heinecke JW. Activation Stone S, Peters G. Activation and silencing of matrix metalloproteinases. Semin. Cell Dev. Biol. 19, 2–13 (2008).
[5] Elizabeth C Naylor, Rachel EB Watson, Michael Sherratt. Molecular aspects of skin ageing. Maturitas 69(3):249-256.
[6] Claudio Franceschi, Miriam Capri, Daniela Monti, Sergio Giunta, et al. Inflammaging and anti-inflammaging: A systemic perspective on aging and longevity emerged from studies in humans. Mechanisms of Ageing and Development. Volume 128, Issue 1, January 2007, Pages 92-105
[7] Adler AS, Kawahara TL, Segal E, Chang HY. Reversal of aging by NFκB blockade. Cell Cycle 7, 556–559 (2008).
[8] Yeon Ja Choi, Kyoung Mi Moon, et al. The underlying mechanism of proinflammatory NF-κB activation by the mTORC2/Akt/IKKα pathway during skin aging. Oncotarget. 2016 Aug 16; 7(33): 52685–52694.
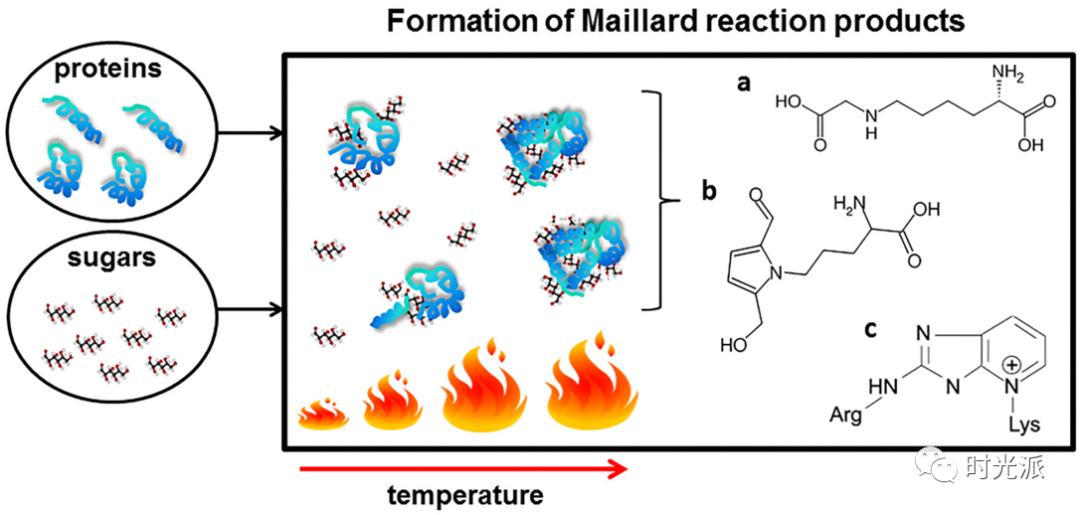
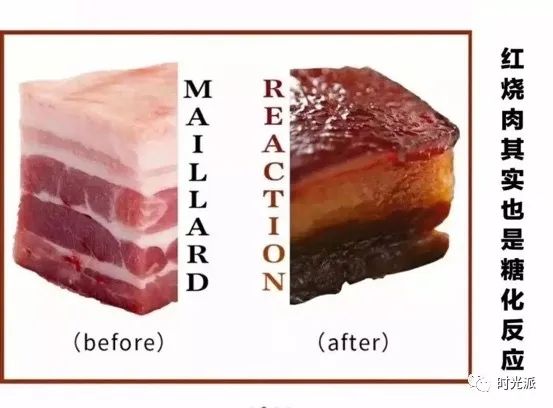
[9] https://en.wikipedia.org/wiki/Maillard_reaction
[10] [美] R. B. 麦克唐纳 衰老生物学. 北京: 科学出版社.
[11] Furber JD. Extracellular glycation crosslinks: prospects for removal. Rejuvenation Res 2006;9:274-278.
[12] Kueper T, Grune T, Prahl S, et al. Vimentin is the specific target in skin glycation. Structural prerequisites, functional consequences, and role in skin aging. J Biol Chem. 2007 Aug 10;282(32):23427-23436.
[13] Gkogkolou P, Bohm M. Advanced glycation end products: Key players in skin aging? Dermatoendocrinol. 2012 Jul 1;4(3):259-270.
[14] Masaki H, Okano Y, Sakurai H. Generation of active oxygen species from advanced glycation end-products (AGEs) during ultraviolet light A (UVA) irradiation and a possible mechanism for cell damaging. Biochim Biophys Acta. 1999 Jun 28;1428(1):45-56.
[15] Bierhaus A, Humpert PM, Morcos M, et al. Understanding RAGE, the receptor for advanced glycation end products. J Mol Med (Berl). 2005 Nov;83(11):876-886.
[16] Rodrigo T. Calado, William T. Yewdell, Keisha L. Wilkerson, Joshua A. Regal, Sachiko Kajigaya, Constantine A. Stratakis, Neal S. Young. Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells. Blood (2009) 114 (11): 2236–2243.
[17] Ch C Zouboulis. Intrinsic skin aging. A critical appraisal of the role of hormones. Der Hautarzt; Zeitschrift fur Dermatologie, Venerologie, und Verwandte Gebiete, 01 Sep 2003, 54(9):825-832.
[18] Ina M.Hadshiew, Mark S.EllerBarbara, A.Gilchrest. Skin aging and photoaging: The role of DNA damage and repair. American Journal of Contact Dermatitis. Volume 11, Issue 1, March 2000, Pages 19-25.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




