- +1
《自然》:科学家发现全新免疫机制,普通细胞也能诱捕并中和超级细菌释放的杀伤性毒素
原创 奇点糕 奇点网

前不久,美国纽约大学医学院微生物学家Ken H. Cadwell和Victor J. Torres领衔的研究团队,在顶级期刊《自然》上发表的重磅研究成果[1],再一次刷新了我对人体先天性免疫的认知。
他们发现,人体细胞在发现超级耐药菌的DNA之后,竟然会把细胞膜表面能被细菌毒素结合的蛋白以外泌体的形式分泌出去。如此以来,超级细菌释放的杀伤性毒素就被外泌体诱捕了,让细胞躲过一劫。
不得不说,咱们人体细胞这招“壁虎断尾”的手段,实在是高明极了。
研究人员认为,他们可能发现了一种对抗细菌感染的全新先天性免疫机制[2]。

耐甲氧西林金黄色葡萄球菌(MRSA)是一种常见的超级细菌,对很多抗生素产生了耐药性。它能通过分泌孔道形成毒素(PFTs)破坏宿主的细胞膜,导致宿主细胞死亡[3]。
不过研究人员观察到一个现象,在美国大约有五分之一的人身上有MRSA,但是死于MRSA感染的人极少,大约在万分之一左右[4]。
这促使Cadwell和Torres思考一个问题:在人体内是不是也存在一种可以中和孔道形成毒素的先天性免疫机制呢?

基于之前的研究,Cadwell和Torres已经知道,细菌分泌的孔道形成毒素会与细胞表面的金属蛋白酶ADAM10结合,导致细胞膜穿孔[5]。而在五年前,Cadwell和Torres已经联手发现细胞的自噬蛋白ATG16L1能保护细胞免遭MRSA孔道形成毒素(α-毒素)的伤害[6]。
那么自噬蛋白ATG16L1、金属蛋白酶ADAM10和孔道形成毒素之间究竟是什么关系呢?背后会不会隐藏着一种鲜为人知的先天免疫机制呢?
要搞清楚上面的两个问题,就得先在细胞内理清ATG16L1和ADAM10之间的关系。

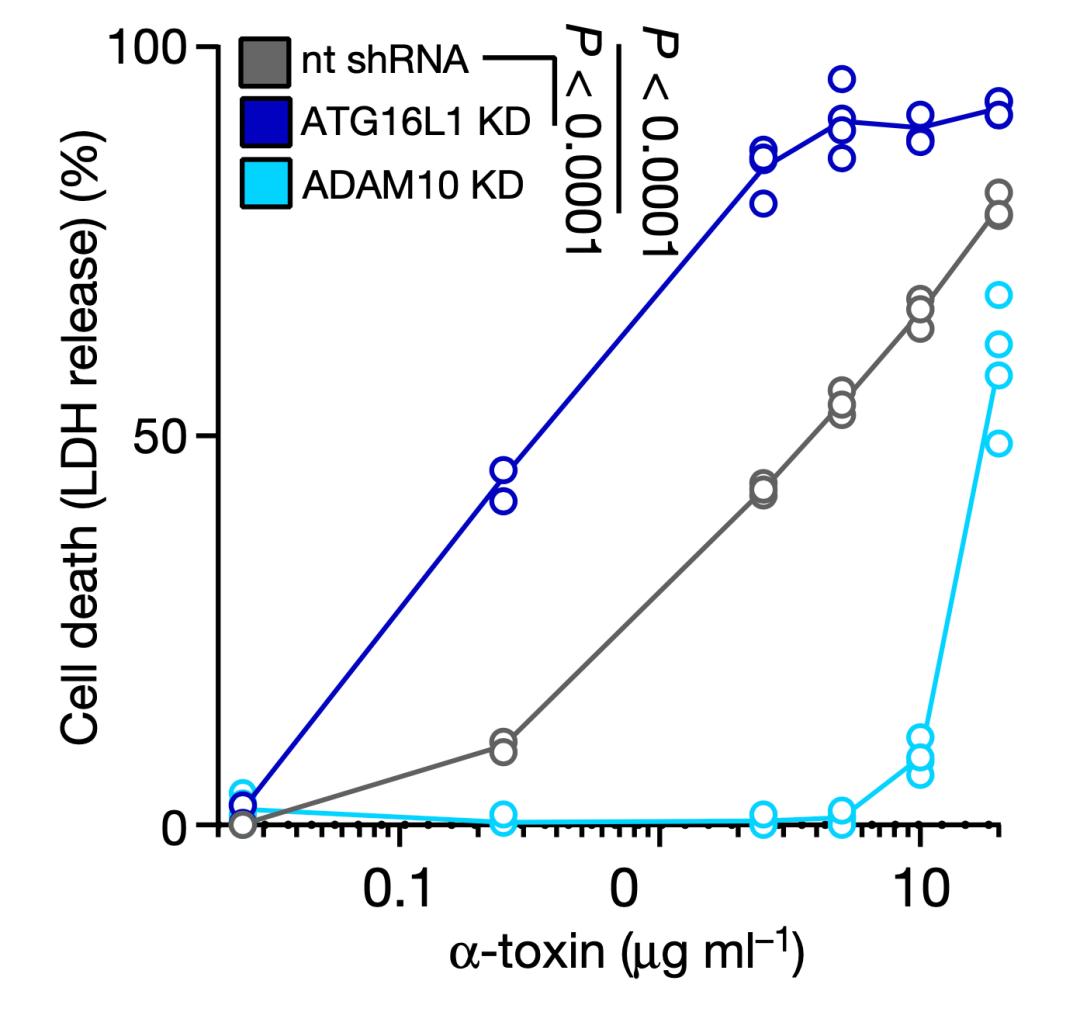
Cadwell和Torres团队首先在人肺泡上皮细胞系中抑制ATG16L1基因的表达,结果ADAM10的表达水平升高了。用纯化的α-毒素处理ATG16L1基因表达水平低的细胞,导致细胞大量死亡;而ADAM10基因表达被抑制的细胞,则对α-毒素有抗性。
这个结果表明,α-毒素受体ADAM10的表达水平是受ATG16L1负调控的。简单地讲,ATG16L1通过降低细胞表面ADAM10的数量,让细胞对MRSA分泌的α-毒素有了抗性。
那这个过程是如何发生的呢?
由于ATG16L1是个自噬蛋白,研究人员首先想到的自噬,即ATG16L1调集自噬通路,把ADAM10降解了。不过,Cadwell和他的同事却发现,ATG16L1降低ADAM10的水平,与自噬没有一丁点儿关系。
继续查阅相关资料之后,Cadwell团队发现,ATG类蛋白还可以促进细胞释放外泌体[7]。巧的是,ADAM10竟然会出现在直径为40nm-120nm的外泌体上[8]。
难道说ATG16L1让细胞把α-毒素的受体ADAM10装在外泌体表面释放掉了?
Cadwell和他的同事迅速掉头分析了ATG16L1表达被抑制的细胞和正常细胞分泌的外泌体的情况。
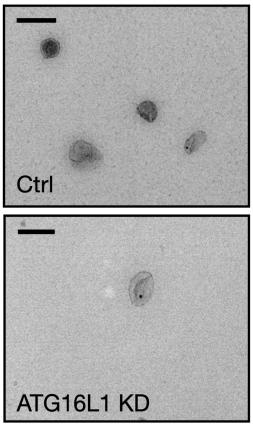
果不其然,ATG16L1表达降低之后,携带ADAM10的外泌体大幅减少了。而且他们还证实,ATG16L1是通过调节外泌体的形成达到降低细胞表面ADAM10的目的,而不是对ADAM10本身发生作用。
到这里,前面提出的第一个问题基本就算说清楚了:ATG16L1通过促进外泌体的形成,降低细胞表面的ADAM10,避免细胞被α-毒素破坏。
那么细胞的这一过程究竟是不是受细菌感染的调控呢?
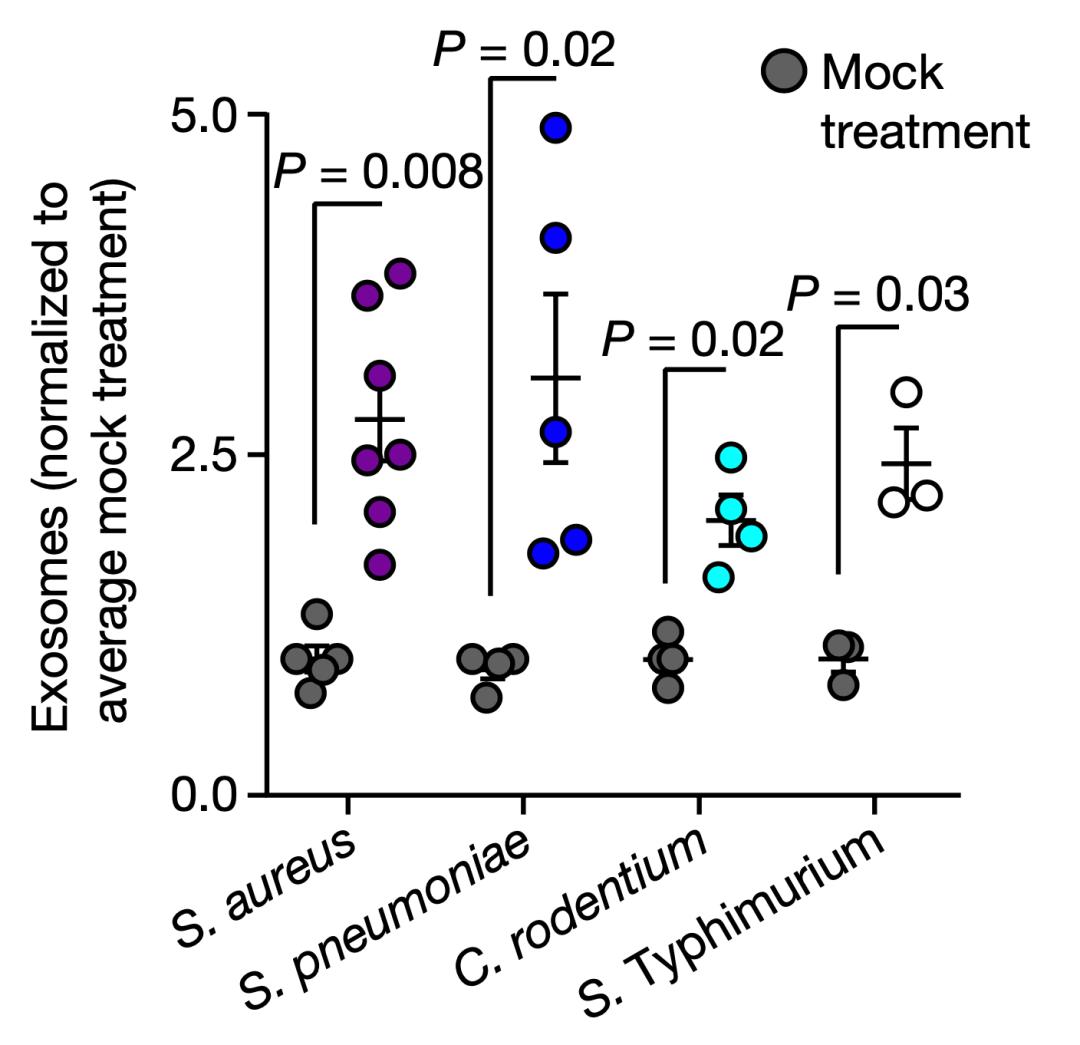
为了解决这个问题,Cadwell团队用高温杀死多种细菌,然后再用这些细菌刺激人和小鼠的细胞,结果外泌体的分泌都显著增加了。在分别测试了细菌身上的多种物质之后,他们确定是细菌的DNA诱发了外泌体的大量分泌。
小鼠的实验也证实,如果抑制ATG16L1的表达,用细菌处理也不能促进外泌体的产生。
基于此,研究人员认为:是细菌的DNA被细胞识别,促进了ATG16L1参与的外泌体分泌过程,最终导致大量携带ADAM10的外泌体被分泌到细胞外。
那么细胞在感应到细菌的存在之后,释放的外泌体究竟有没有防御功能呢?
研究人员分别从ATG16L1低表达和正常表达的细胞系中分离外泌体,然后用这些外泌体和α-毒素一起处理肺泡上皮细胞。结果如研究人员所料,ATG16L1正常表达的细胞产生的外泌体,对肺泡上皮细胞有保护作用,而ATG16L1低表达的细胞外泌体则没有保护作用。
不过当加入更多ATG16L1低表达的细胞外泌体之后,这种保护作用也逐渐显现。这再次表明,保护作用是由外泌体数量决定的。随后的小鼠体内实验也再次证实了上述过程。
除此之外,研究人员还发现,不同的细胞类型分泌的外泌体携带有不同类型的毒素受体,这也意味着不同细胞分泌的外泌体,或许可以诱捕并中和不同的细菌毒素。
基于以上研究,Cadwell团队认为,他们的研究表明,细胞分泌外泌体可能是一种防御细菌感染的全新先天性免疫反应。它通过释放携带毒素结合蛋白的外泌体,诱捕细菌释放的各种毒素,防止人体细胞或组织被细菌伤害。
Torres认为,这项研究结果不仅让我们对哺乳动物防御感染有了全新的认知,而且还提出了一个加强免疫系统的新策略——可以通过向体内注入人工的外泌体来吸收细菌毒素,或者通过促进外泌体的产生来增强人体的防御能力[4]。
奇点糕认为,科学真的很迷人。
参考资料:
[1].Keller M D, Ching K L, Liang F X, et al. Decoy exosomes provide protection against bacterial toxins[J]. Nature, 2020, 579(7798): 260-264.
[2].Du Toit A. Distracting your enemy with bubbles[J]. Nature Reviews Microbiology, 2020, 18(5): 263-263.
[3].Dal Peraro M, Van Der Goot F G. Pore-forming toxins: ancient, but never really out of fashion[J]. Nature reviews microbiology, 2016, 14(2): 77.
[4].https://nyulangone.org/news/newfound-cell-defense-system-features-toxin-isolating-sponges
[5].Inoshima I, Inoshima N, Wilke G A, et al. A Staphylococcus aureus pore-forming toxin subverts the activity of ADAM10 to cause lethal infection in mice[J]. Nature medicine, 2011, 17(10): 1310.
[6].Maurer K, Reyes-Robles T, Alonzo III F, et al. Autophagy mediates tolerance to Staphylococcus aureus alpha-toxin[J]. Cell host & microbe, 2015, 17(4): 429-440.
[7].Cadwell K, Debnath J. Beyond self-eating: The control of nonautophagic functions and signaling pathways by autophagy-related proteins[J]. Journal of Cell Biology, 2018, 217(3): 813-822.
[8].Stoeck A, Keller S, Riedle S, et al. A role for exosomes in the constitutive and stimulus-induced ectodomain cleavage of L1 and CD44[J]. Biochemical Journal, 2006, 393(3): 609-618.


本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




