- +1
隐秘的角落:肿瘤免疫治疗光环下的副作用
原创 黄涛 CellPress细胞科学 来自专辑Cell Press青促会述评

Life science
作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。
第十四期专栏文章,由中国科学院上海营养与健康研究所副研究员、中国科学院青促会会员 黄涛,就Cell 中的论文发表述评。

近些年,肿瘤免疫治疗的发展如火如荼,被人们寄予厚望。尤其是在美国科学家詹姆斯艾利森和日本科学家本庶佑获得2018年诺贝尔生理学或医学奖之后,多个免疫治疗药物获批更是引发了巨大的轰动。然而,评价一种疗法除了看疗效,还要看副作用。以药物开发经常使用的指标IC50(半抑制浓度)为例,人们更希望以很小的剂量就达到治疗的效果,往往大的剂量意味着更多的副作用。那么,免疫治疗是否真像看上去那么完美?它们的副作用究竟怎样?
2011年,第一款细胞毒性T细胞抗原-4(CTLA-4)抑制剂伊匹单抗(Ipilimumab)被美国FDA批准用于治疗晚期黑色素瘤,临床应用发现该治疗方法存在肠炎反应、引发自体免疫性疾病,皮疹、头痛、恶心、体重下降等副作用。同样,程序性死亡受体1(PD-1)免疫药物的副作用也非常多,包括疼痛、发烧、疲乏、咳嗽、恶心、瘙痒、皮疹、食欲减退、便秘、腹泻、心肌炎等。解析这些免疫疗法副作用产生的机制对完善治疗方法,减少病人痛苦和提高治疗效果都具有重要意义。
近期Cell杂志上发表了哈佛大学Kai W. Wucherpfennig和Michael Dougan研究组的工作Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy[1]。这篇文章通过比较正常人和使用CTLA-4和PD-1抑制剂免疫治疗的黑色素瘤病人的单细胞测序数据,发现了肿瘤免疫疗法引发肠炎反应副作用的可能机制(图1)。
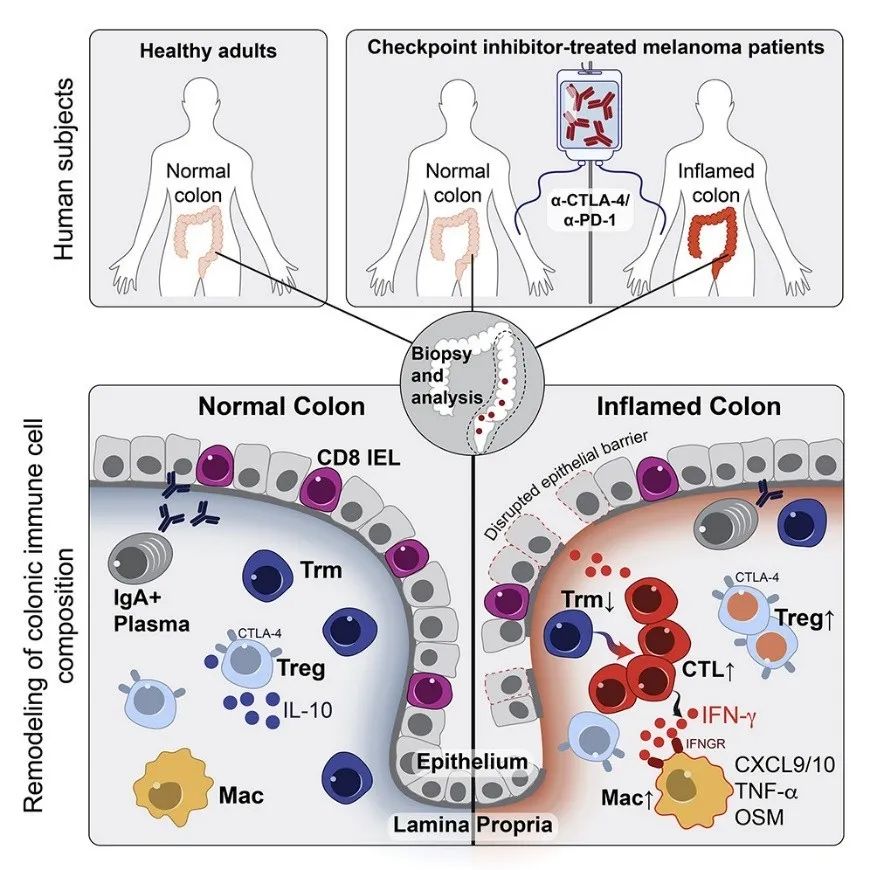
该研究聚焦在肠炎反应,包括了8个产生肠炎反应的黑色素瘤病人,8个正常人,6个无肠道炎性反应黑色素瘤病人。作者通过单细胞转录组测序得到了51,652个细胞的表达谱,其中包括了T 细胞,B 细胞,髓系细胞(myeloid cells),肥大细胞(mast cells),先天淋巴细胞 (innate lympoid cells, ILCs)等。作者发现有和无肠道炎性反应病人最大的差异在T细胞群体的差异。在有肠炎反应的病人中存在毒性T细胞(cytotoxic T cells)和增殖T细胞(cycling T cells)的富集。同时该研究还纠正了一些之前的看法,例如Simpson等人认为CTLA-4免疫治疗能够导致黑色素瘤Treg细胞的耗竭(Treg cell depletion)[2],但是在该研究中,并未发现Treg细胞比例的降低。这也展示了单细胞技术可以从更微观的层面揭示以前观察不到的现象。此外,T细胞受体(TCR)序列分析表明,相当一部分肠炎相关毒性T细胞和增殖T细胞来源于组织常驻记忆T细胞(tissue-resident memory T cells,Trm),这解释了为什么治疗开始后肠炎症状往往迅速出现。最后,作者找出了多个关键基因,例如在肠炎反应病人骨髓细胞里高表达的趋化因子CXCL9和CXCL10,T细胞里高表达的CXCR6,骨髓细胞和肥大细胞里高表达的CXCL16等,提示IFN信号通路在引发炎症反应方面发挥重要作用。
由于免疫治疗药物的诞生时间相对较短,有很多潜在的副作用还不清楚。除了该研究的CTLA-4和PD-1抑制剂之外,一些其他的免疫治疗药物的副作用也应给予关注。另外,针对MSI-H(高微卫星不稳定性)和TMB-H(高肿瘤突变负荷)这样的泛癌种免疫治疗,是否不同的癌症会产生不同的副作用也值得研究。
本文参考文献
[1] A.M. Luoma, S. Suo, H.L. Williams, T. Sharova, K. Sullivan, M. Manos, P. Bowling, F.S. Hodi, O. Rahma, R.J. Sullivan, G.M. Boland, J.A. Nowak, S.K. Dougan, M. Dougan, G.C. Yuan, K.W. Wucherpfennig, Molecular Pathways of Colon Inflammation Induced by Cancer Immunotherapy, Cell, (2020).
[2] T.R. Simpson, F. Li, W. Montalvo-Ortiz, M.A. Sepulveda, K. Bergerhoff, F. Arce, C. Roddie, J.Y. Henry, H. Yagita, J.D. Wolchok, K.S. Peggs, J.V. Ravetch, J.P. Allison, S.A. Quezada, Fc-dependent depletion of tumor-infiltrating regulatory T cells co-defines the efficacy of anti-CTLA-4 therapy against melanoma, The Journal of experimental medicine, 210 (2013) 1695-1710.
论文摘要
用PD-1和CTLA-4抑制受体的特异性抗体阻断免疫检查点,可以在多种人类癌症中诱发持久的反应。但是,我们对于引发严重炎症副作用的免疫学机制仍然知之甚少。在本文,我们报告了针对免疫检查点抑制常见副作用肠炎的免疫细胞群,进行的全面单细胞分析。我们观察到具有高度细胞毒性和增殖状态的CD8 T细胞的惊人堆积,而没有调节性T细胞耗竭的证据。T细胞受体(TCR)序列分析表明,相当一部分肠炎相关CD8 T细胞来源于组织常驻细胞,这解释了为什么治疗开始后肠炎症状往往迅速出现。我们的分析还发现了可以作为肠炎和其它免疫检查点阻断导致的炎症副作用治疗靶点的细胞因子、趋化因子和表面受体。
Checkpoint blockade with antibodies specific for the PD-1 and CTLA-4 inhibitory receptors can induce durable responses in a wide range of human cancers. However, the immunological mechanisms responsible for severe inflammatory side effects remain poorly understood. Here we report a comprehensive single-cell analysis of immune cell populations in colitis, a common and severe side effect of checkpoint blockade. We observed a striking accumulation of CD8 T cells with highly cytotoxic and proliferative states and no evidence of regulatory T cell depletion. T cell receptor (TCR) sequence analysis demonstrated that a substantial fraction of colitis-associated CD8 T cells originated from tissue-resident populations, explaining the frequently early onset of colitis symptoms following treatment initiation. Our analysis also identified cytokines, chemokines, and surface receptors that could serve as therapeutic targets for colitis and potentially other inflammatory side effects of checkpoint blockade.
中文内容仅供参考,请以英文原文为准
述评人简介

中国科学院青促会会员
中国科学院上海营养与健康研究所副研究员
黄涛,副研究员,中国科学院上海生命科学研究院营养与健康研究所,曾在美国纽约西奈山伊坎医学院遗传与基因组科学系从事博士后研究。研究兴趣包括计算生物学,网络分析和机器学习,累计引用超过7500次,是大数据研究高被引作者。担任过超过25份杂志的编委或客座编辑,担任超过100份杂志的审稿人,主编了Methods in Molecular Biology丛书Computational Systems Biology - Methods and Protocols和Precision Medicine - Methods and Protocols分册。
Tao Huang is an Associate Professor at Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences. He completed his post-doctoral research at Department of Genetics and Genomics Sciences, Icahn School of Medicine at Mount Sinai, New York City, USA. His research interests include computational biology, network analysis and machine learning. His works have been cited for over 7500 times and is big data research top cited articles award winner. He has been editors or guest editors for over 25 journals and reviewers for over 100 journals. He has edited two books for Methods Molecular Biology: Computational Systems Biology - Methods and Protocols and Precision Medicine - Methods and Protocols.
相关论文信息
原文刊载于CellPress细胞出版社旗下期刊Cell上,


Youth Innovation Promotion Association (YIPA) was founded in 2011 by the Chinese Academy of Science (CAS). It aims to provide support for excellent young scientists by promoting their academic vision and interdisciplinary research. YIPA has currently more than 4000 members from 109 institutions and across multiple disciplines, including Life Sciences, Earth Science, Chemistry& Material, Mathematics & Physics, and Engineering. They are organized in 6 discipline branches and 13 local branches.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




