- +1
吴潍龙团队综述:冠状病毒RNA校对及药物治疗
原创 Cell Press CellPress细胞科学 来自专辑Cell Press新冠资源中心

Life science
对全球公共卫生和经济造成严重破坏的2019年冠状病毒疾病(COVID-19)使人们更关注到缺乏有效的抗病毒治疗药物。香港中文大学吴潍龙教授领导香港、英国、越南、法国和土耳其的科学家深入调查冠状病毒的RNA复制和校对机制,以助新药研发。相关结果发表在Cell Press细胞出版社旗下期刊Molecular Cell上。
RNA病毒复制通常具有较高的出错率(较低的病毒保真度),从而导致病毒出现不同的基因组突变体种群存在。低复制保真度使RNA病毒适应选择性压力,但同时也增加了导致死性突变的机会。这表明病毒需要在准种多样性与复制适应性之间达到微调的平衡,以适应病毒的毒力和进化。这个因素挑战了抗CoV和其他RNA病毒的抗病毒药物开发,尤其是核苷类似物(NA),因病毒可快速发展对药物的耐药性同时保持病毒的复制适应性。另外,NAs开发的障碍是独特的CoV 核酸外切酶(ExoN)校对机制。SARS-CoV nsp14-ExoN突变体比野生型突变体积累多达20倍的突变,因此nsp14的核酸外切酶校对功能可能是成为复制能力的关键因素。该文章探讨了CoV校对复合物的分子基础,并评估将现有的核苷类似物和新的基因组技术视为潜在的抗冠状病毒治疗剂,可单独使用或结合使用以靶标向校对机制。

非结构蛋白nsp14校对复合物
Nsp14是一种60 kDa双功能酶 。nsp14 C端N7-MTase结构域包含在CoV中保守的DxG S-腺苷-L-蛋氨酸(SAM)结合基序,并参与mRNA加帽和先天免疫反应逃避,而nsp14 N端具有一个与复制保真度有关的N末端3'-5'核酸外切酶(ExoN)结构域,通过从延伸的RNA链的3'末端去除错配的核苷酸来纠正 RNA依赖性RNA聚合酶 (RdRp) 产生的错误。其中,ExoN结构域内的四个保守催化残基Asp90,Glu92,Glu191,His268和Asp273 属于DEDD核酸外切酶超家族,形成两个金属结合位点,通过两个分子来驱动核苷酸切除金属离子辅助工艺。研究显示,鼠肝炎病毒(MHV)和SARS-CoV病毒ExoN突变体可以在细胞培养物中复制具有生长缺陷,更高的突变密度和突变率。另外, Ogando等测试了多种MERS-CoV ExoN突变体中只有一个ExoN突变体能够在细胞培养物中复制。而且,ExoN野生型和Exon-D191E突变体显示出对诱变剂5-FU相当的敏感性,而突变体的敏感性仅比WT略有增加。这些数据反影了ExoN在CoV中除了校对机制,可能更具有基本的RNA合成机理。
核苷类似物(Nucleoside Analogs)
核苷类似物(NAs)可通过两种方式方式发挥其抑制作用﹕1)导致天然核苷酸错配,导致RNA链错误同化及基因组出现致死性突变;2)它们的掺入可能会提前终止正在延伸的RNA或DNA链。重新利用现有的抗病毒药物(已批准的和实验的药物)对抗冠状病毒已被认为控制冠状病毒爆发的有效疗法的最快策略。许多研究显示NAs具有抗CoV活性 (表一) 。

尾注﹕ VEEV﹕委内瑞拉马脑炎病毒;MERS-CoV﹕中东呼吸综合征冠状病毒;SARS-CoV﹕严重急性呼吸系统综合症冠状病毒;HAE﹕人气道上皮细胞
NAs作为药物存在许多局限性,如NA通常作为前药提供,一旦进入细胞,必须将其磷酸化为三磷酸形式才能被聚合酶识别。而且,将NA转化为单磷酸酯形式的第一个磷酸化反应通常是限速的,因此NA可能无法被识别并且似乎没有活性。另外 ,在一项研究中发现虽然SARS-CoV对利巴韦林(RBV)和诱变剂5-氟尿嘧啶(5-FU)均具有抗性,但敲除ExoN功能导致对化合物的敏感性提高了300倍,这表明冠状病毒在RNA合成过程中ExoN去除错配核苷酸的独特能力已导致冠状病毒对许多NA的天然抗性。因此,非常有必要对可能逃避ExoN校对活动的NA进行合理设计。
反义寡核苷酸(Antisense Oligonucleotides)
反义寡核苷酸(ASO)是约20个核苷酸的单条DNA链,并可以诱导宿主RNase H酶催化的mRNA切割,改变剪接或形成空间阻断来破坏RNA翻译,从而破坏目标蛋白的表达(图一)。由于ASOs对各种核酸酶具有抗性,因此在细胞和细胞外环境中都可以稳定运行数小时,ASOs非常适用于体内模型和临床应用。Rocchi等证明脂质的ASO(LASO)具有自组装成纳米胶束的能力,无需转染剂即可有效吸收ASO。这些LASO纳米结构可以封装疏水化学疗法并协助其递送,可使化合物在水中的溶解度更高,并提高了化合物的功效。形成的杂化纳米胶束的理化特性亦可以以吸入气雾剂进行给药,显著降低毒性并将抗病毒化合物靶向肺部。例如,在抗病毒LASO纳米复合物中封装NAs(如RDV)可作为组合疗法,与NAs同时递送特定的ASO,能增强NAs或其他抗病毒治疗的效果。
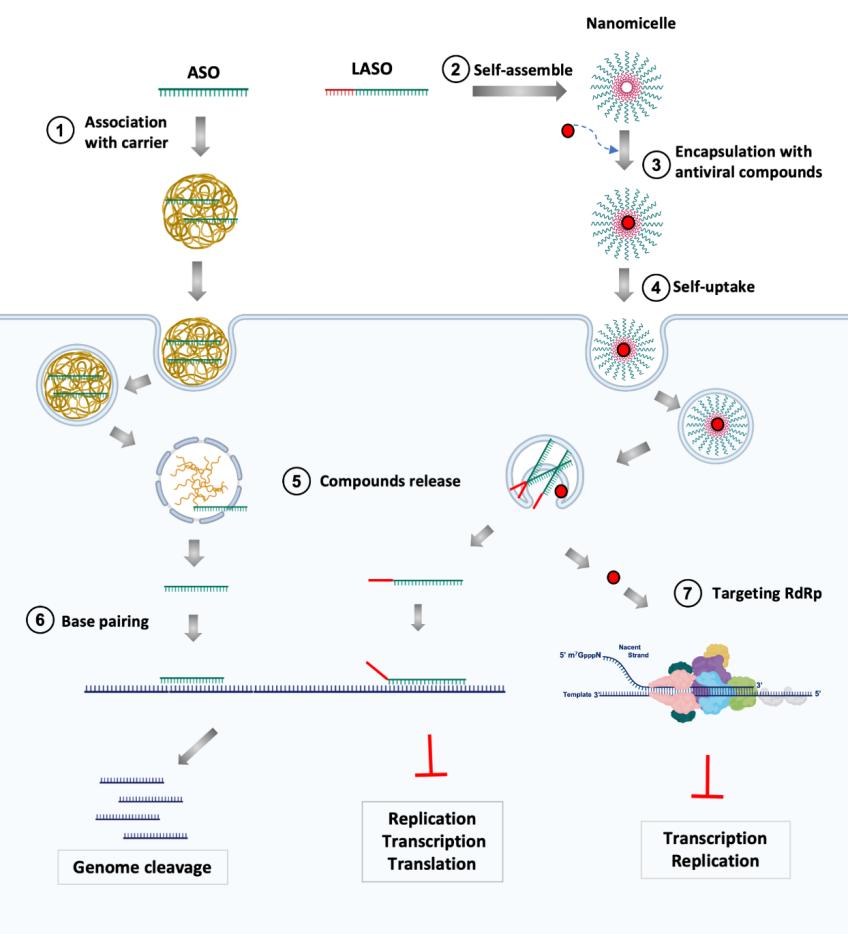
ExoN 3'-5'核酸外切酶的活性是冠状病毒生命周期中许多过程的关键因素,并且使一些以往成功的抗病毒化合物对CoV无效。值得注意的是,抑制ExoN校对活性的主要结果是致命诱变,而病毒校对机制的选择性靶向可能引致非想望的选择压力,导致出现少数甚至更具活力的突变菌株。由于ExoN在CoVs中在结构和功能上均是保守的,并且该因素加上病毒基因组中功能的冗余性缺失,使ExoN成为抗CoV策略的易受攻击目标。通过核酸基因技术的方法抑制ExoN活性,同时用已批准的NAs进行治疗,可以增强NAs的有效性,从而降低病毒复制的保真度,从而减轻疾病。使用这样的治疗策略,将具有不同作用方式或在病毒复制过程中干扰不同过程的药物结合起来,也可能会增加耐药性的障碍。


教授
香港中文大学药学院吴潍龙教授的研究方向为化学生物学和药物研发。其实验室使用化学,分子生物学和生物信息学工具开发新的化学小分子,用于治疗和诊断各种人类疾病,包括癌症,糖尿病, 冠状病毒感染和神经退行性疾病。吴潍龙教授在香港中文大学获得化学学士(一等荣誉)和博士学位,亦曾是麻省理工学院(MIT)的富布赖特学者。从2014年至2016年,他获裘槎基金會资助加入牛津大学,担任化学系博士后研究员。从2016年至2019年,他被聘为哈佛医学院/ Dana-Farber癌症研究所的研究员。其近年的研究成果发表于 Science, Nature Chemical Biology,Cancer Discovery,Molecular Cell,Journal of the American Chemical Society 以及 Angewandte Chemie 等著名国际期刊。
相关论文信息
相关结果发表在CellPress期刊Molecular Cell上,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Coronavirus RNA proofreading: molecular basis and therapeutic targeting
▌论文网址:
https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30518-9
▌DOI:
https://doi.org/10.1016/j.molcel.2020.07.027
Cell Press冠状病毒资源中心
Cell Press新冠资源中心
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




