- +1
辉瑞疫苗为何被推荐紧急使用?新英格兰医学杂志披露申请基础
当地时间12月10日,美国食品药品管理局(FDA)疫苗与相关生物制品专家组21名成员以17票赞成、4票反对和1票弃权的投票结果,推荐FDA给予德国BioNTech和美国辉瑞公司合作开发的mRNA新冠疫苗紧急使用授权。

也就在同一天,顶级医学期刊《新英格兰医学杂志》(NEJM)在线发表了一篇论文,披露了上述BNT162b2的3期临床试验的中期分析结果。研究团队称,这一论文中的数据和试验结果是申请紧急使用授权的基础。但关于疫苗免疫原性和免疫应答持久性的2/3期数据的收集正在进行中,不作报道。
论文提到,中国团队向全球公布新冠病毒基因组序列后,也就是1月10日,BNT162b2的开发工作就开始启动。这一新型的mRNA疫苗是一种纳米颗粒配方、核苷修饰RNA疫苗,能够编码融合前稳定、膜锚定的SARS-CoV-2全长刺突蛋白。
在这项仍在进行中的多国、安慰剂对照、观察者盲化的关键有效性试验中,研究团队以1:1比例将≥16岁的人随机分组,分别间隔21天接受两剂安慰剂或BNT162b2候选疫苗接种(每剂30μg)。
这项疫苗临床试验的主要终点为预防COVID-19的有效性和安全性。此次发表的这篇论文报告了在初始人群中检测到的前170个COVID-19病例,并包括中位2个月的安全性数据。
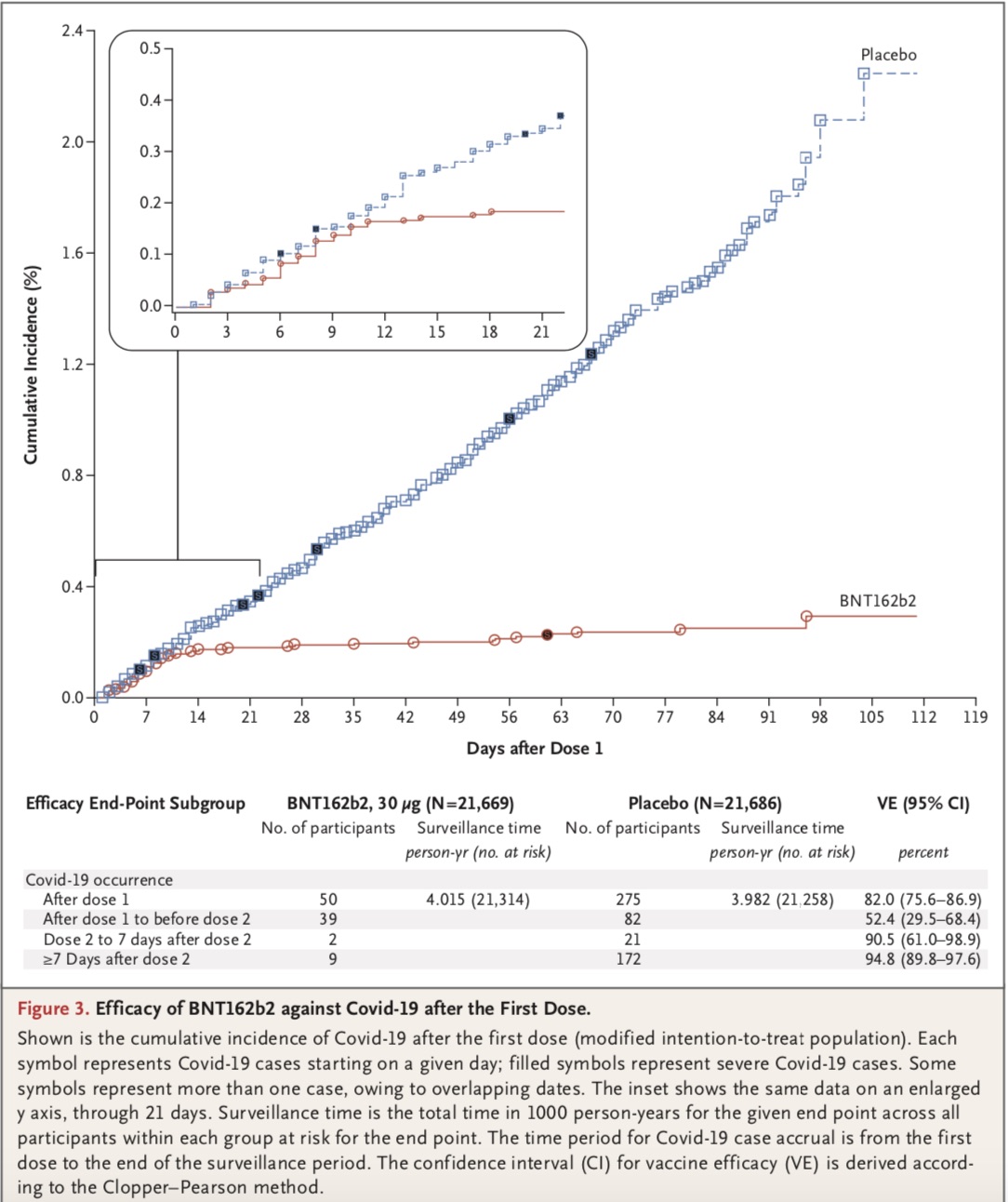
论文结论显示,总共43548例参与者被随机分组,其中43448例接受注射:21720例注射了BNT162b2,21728例注射了安慰剂。BNT162b2组8例参与者和安慰剂组162例参与者在第二剂注射后≥7日发病。
在预防COVID-19方面,BNT162b2的有效率为95%(95%可信区间:90.3-97.6)。在根据年龄、性别、人种、族群、基线体质指数和合并症存在情况定义的各亚组中,均观察到了相似的疫苗有效率(通常为90%-100%)。
在第一剂注射后发生的10例重症COVID-19中,9例发生在安慰剂接种者中,1例发生在BNT162b2接种者中。
BNT162b2安全性特征包括短期的轻度至中度注射部位疼痛、疲劳和头痛。论文提到,在疫苗组和安慰剂组中,严重不良事件发生率较低并且相似。

研究团队认为,对于≥16岁的人群,BNT162b2两剂接种方案预防COVID-19的有效率为95%。中位2个月期间的安全性与其他病毒疫苗相似。
研究团队在讨论中指出,这些结果表明,COVID-19可以通过免疫预防,为基于RNA的疫苗这一新方法的概念提供了证据,并证明了只要投入足够的资源,RNA疫苗可以快速开发,BNT162b2从开发到现在仅经历了11个月。值得注意的是,截至目前,尚未有mRNA疫苗被正式批准商业化使用。
研究团队称,在目前疫情仍在大流行的背景下,如果获得批准,BNT162b2疫苗可与其他公共卫生措施一起有助于减少OVID-19全球传播造成的健康、生命以及经济和社会福祉的毁灭性损失。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




