- +1
【学术前沿】张令强/谢萍团队发现Neddylation修饰的PTEN蛋白的抑癌功能并促进乳腺癌的发…
责编丨兮
PTEN是继p53后另一个较为广泛地与肿瘤发生关系密切的抑癌基因,纯合缺失PTEN基因的小鼠胚胎致死,杂合缺失PTEN基因的小鼠则自发形成多种类型的肿瘤,PTEN在多种肿瘤中的突变或者缺失与肿瘤发生高度相关。然而在乳腺癌患者体内PTEN突变率极低,但仅仅20-30%的PTEN蛋白水平降低即可以促进乳腺癌的发生发展,其中机制不明。已知胞浆中PTEN蛋白的主要功能是通过其脂质磷酸酶活性,调节第二信使PIP3的磷酸化水平,阻断Akt/PKB通路,PTEN的失活将导致PI3K/Akt通路处于持续性活化状态。核内PTEN蛋白可以与p53形成核内复合体,抑制p53降解并增强p53的转录活性;能够与组蛋白H1结合,影响组蛋白H1的动态活性,与RAD51相互作用调节DNA同源重组修复,调控PARP1参与DNA双链断裂修复通路,从而调节染色体重塑和基因表达,因此PTEN缺失的细胞对于DNA损伤极其脆弱。核内PTEN蛋白的缺失会促进肿瘤的发生发展,表明核内PTEN也主要发挥抑癌功能。PTEN如何进入核内是目前的研究热点,PTEN入核受到多种蛋白质翻译后修饰的调控,包括乙酰化、泛素化、类泛素SUMO化修饰。单泛素化修饰驱动PTEN蛋白由胞浆转移至胞核,SUMOylation也是控制PTEN蛋白核内定位的关键。
在一众类泛素分子中,Nedd8是和泛素相似程度最高的分子,所进行的类泛素化修饰称为Neddylation。遗传学证据表明Neddylation为个体发育、存活所必需,与肿瘤的关系尤为密切,Neddylation激活酶(E1)的抑制剂MLN4924已经进入临床前三期肿瘤治疗阶段。上述均表明Neddylation具有极为重要的生物学功能。但是,PTEN蛋白是否发生Neddylation修饰尚无研究。
2020年 12月9日,军事医学研究院张令强研究员、首都医科大学谢萍副教授合作(谢萍副教授和彭志强博士研究生是文章的共同第一作者)在Cell Research上在线发表了题为Neddylation of PTEN regulates its nuclear import and promotes tumor development 的关于Nedd8共价修饰PTEN蛋白并调控其功能的研究性文章。本研究发现重要抑癌蛋白PTEN为Neddylation修饰新底物,Neddylation逆转PTEN蛋白的抑癌功能并促进乳腺癌的发生发展,该工作揭示了重要抑癌蛋白PTEN的全新翻译后修饰,丰富了临床上部分肿瘤中PTEN失活的可能机制,拓展了人们对Neddylation功能的认知,为MLN4924应用于临床乳腺癌治疗提供分类治疗和精准治疗的参考依据。

他们发现:PTEN可以发生Neddylation修饰,并鉴定K197和K402为关键的修饰位点。葡萄糖浓度调控Neddylation连接酶XIAP催化PTEN发生Neddylation修饰,高葡萄糖浓度促进PTEN Neddylation,低葡萄糖浓度则抑制PTEN Neddylation。值得注意的是,Neddylation修饰并不影响PTEN蛋白稳定性和磷酸酶活性,而是促进PTEN在细胞核内聚集。IP-MS结果显示Nedd8可以结合多个入核蛋白importins,提示Neddylation修饰可能介导底物的核质穿梭。Neddylation修饰促进PTEN入核,促使胞浆中PI3K/Akt通路激活,非常有意思的发现是,与已知核内PTEN的抑癌功能截然相反,Neddylation修饰的PTEN入核后结合脂肪酸合成酶FASN,去除FASN的酪氨酸磷酸化修饰,削弱泛素连接酶TRIM21和FASN的相互作用,使FASN与泛素连接酶TRIM21相互作用减弱,FASN蛋白稳定性增强,被活化的FASN增强脂肪酸从头合成途径(图1)。
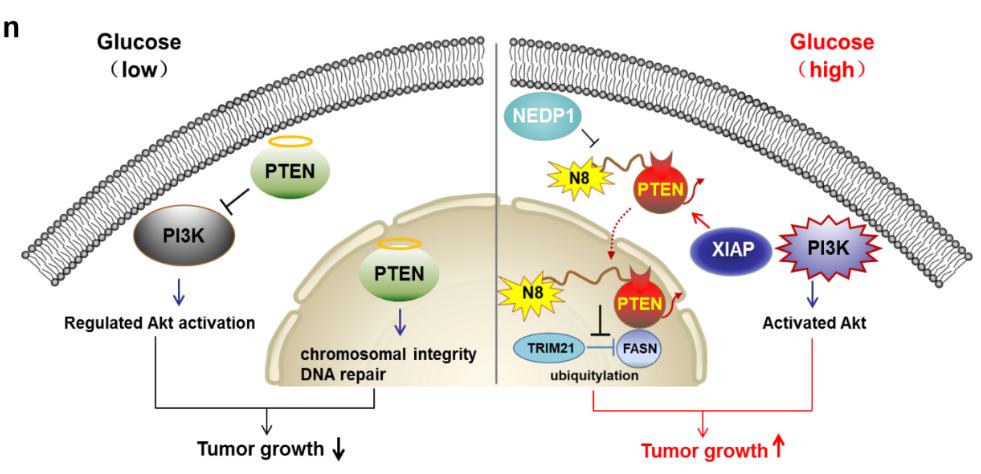
图1. Neddylation修饰调控PTEN作用模式
为了进一步研究PTEN Neddylation修饰在肿瘤发生发展中的功能,研究人员制备了特异性识别PTEN K402位点Neddylation修饰的多克隆抗体,发现170例乳腺癌患者肿瘤样本中PTEN Neddylation修饰水平显著升高,且与Neddylation修饰通路蛋白E1-UBA3、E3-XIAP的表达呈正相关、与NEDP1的表达呈负相关。另外,PTEN Neddylation修饰水平越高,患者预后越差,反之越好。多色免疫荧光芯片分析结果显示,Neddylation修饰后的PTEN与E1-UBA3、E3-XIAP、FASN在乳腺癌患者中存在共定位和共表达,进一步证实PTEN Neddylation促进乳腺癌的恶性发生和发展。
原文链接:
https://www.nature.com/articles/s41422-020-00443-z
参考文献
1. Di-Cristofano A, Pesce B, Cordon-Cardo C, Pandolfi P. Pten is essential for embryonic development and tumour suppression. Nat Genet. 1998, 19:348-355.
2. Song M, Salmena L, Pandolfi P. The functions and regulation of the PTEN tumour suppressor. Nat Rev Mol Cell Biol. 2012, 13:283-296.
3. Bassi C, Ho J, Srikumar T, Dowling RJ, Gorrini C, Miller SJ, Mak TW, Neel BG, Raught B, Stambolic V. Nuclear PTEN controls DNA repair and sensitivity to genotoxic stress. Science 2013, 341:395-399.
4. Shen WH, Balajee AS, Wang J, Wu H, Eng C, Pandolfi PP, Yin Y. Essential role for nuclear PTEN in maintaining chromosomal integrity. Cell 2007, 128:157-170.
5. Enchev RI, Schulman BA, Peter M. Protein neddylation: beyond cullin-RING ligases. Nat Rev Mol Cell Biol. 2015, 16:30-44.
6. Soucy TA, Smith PG, Milhollen MA, Berger AJ, Gavin JM, Adhikari S, Brownell JE, Burke KE, Cardin DP, Critchley S, Cullis CA, Doucette A, Garnsey JJ, Gaulin JL, Gershman RE, Lublinsky AR, McDonald A, Mizutani H, Narayanan U, Olhava EJ, Peluso S, Rezaei M, Sintchak MD, Talreja T, Thomas MP, Traore T, Vyskocil S, Weatherhead GS, Yu J, Zhang J, Dick LR, Claiborne CF, Rolfe M, Bolen JB, Langston SP. An inhibitor of NEDD8-activating enzyme as a new approach to treat cancer. Nature 2009, 458: 732-737.
7. Menendez, J.A. & Lupu, R. Fatty acid synthase and the lipogenic phenotype in cancer pathogenesis.Nat. Rev. Cancer. 2007, 7: 763-777.
8. Lin, H.P. et al. Destabilization of Fatty Acid Synthase by Acetylation Inhibits De Novo Lipogenesis and Tumor Cell Growth. Cancer Res. 2016, 76: 6924-693
来源:BioArt

1980-2020
喜欢此内容的人还喜欢
原标题:《【学术前沿】张令强/谢萍团队发现Neddylation修饰的PTEN蛋白的抑癌功能并促进乳腺癌的发生发展》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




