- +1
鼻拭子+手机显微镜,新冠低成本快速即时筛查
原创 Cell Press CellPress细胞科学
生命科学Life science
2020年1月31日,Cell Press新型冠状病毒资源中心正式开放。您可以在该资源中心页面上查找到COVID-19相关论文的投稿政策,以及Cell Press旗下期刊已发表的有关疫情和病毒的论文。网站正在不断更新中,所有内容都可以免费阅读。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望。点击“阅读原文”或识别下图二维码阅读英文原文最新在中心上线的发表在Cell Press细胞出版社旗下期刊Cell上的研究,名为” Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy”。来自Gladstone 研究所的科研人员发明了一种免扩增的CRISPR-Cas13a检测技术,该技术可从鼻拭子RNA中直接检测SARS-CoV-2,并且可以通过手机显微镜对其进行读取。该检测方法有可能实现针对SARS-CoV-2的低成本快速即时筛查。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望,点击“阅读原文”或识别下图二维码阅读英文原文。
摘要
2019年12月暴发的新型呼吸道病毒SARS-CoV-2现已发展为全球大流行,部分原因是确定感染该病毒的有症状患者、无症状携带者和有前驱症状的携带者十分困难。如果CRISPR诊断程序可以快速、便携和准确地进行,那就可以增强基于PCR的金标准诊断测试。在此,我们报告了一种免扩增的CRISPR-Cas13a检测技术,该技术可从鼻拭子RNA中直接检测SARS-CoV-2,并且可以通过手机显微镜对其进行读取。该测定法在30分钟的测量时间内即可达到约100拷贝/μL的灵敏度,并且能在5分钟内从一组阳性临床样品中准确地检测出预提取的RNA。我们结合了靶向SARS-CoV-2 RNA的crRNA来提高这一检测方法的敏感性和特异性,并利用酶动力学直接量化了病毒载量。结合手机读取设备,该检测方法有可能实现针对SARS-CoV-2的低成本快速即时筛查。

简介
目前,SARS-CoV-2感染的金标准诊断方法是定量逆转录聚合酶链反应(RT-qPCR),这也是一种广泛应用于筛查的成熟检测手段。基于针对核衣壳(N)蛋白、包膜(E)蛋白和开放阅读框1ab(ORF1ab)基因的引物,RT-qPCR的分析检测限度(LOD)为1,000病毒RNA拷贝/ mL,即1拷贝/μL(Vogels et al., 2020)。然而,最新的病毒动力学模型表明,为了控制当前的大流行,我们需要一种能够快速周转的高频检测手段(Larremore et al., 2020)。值得注意的是,该模型将检测的敏感性列为较低优先级,估计100,000拷贝/ mL(100拷贝/μL)的LOD就足以达到筛查水平(Larremore et al., 2020)。尽管研究人员对于所需的准确目标LOD尚未达成广泛共识,但高频检测和快速周转有助于减少病毒传播,即使检测的敏感性不高。在临床研究中,当病毒载量在1,000,000百万拷贝/ mL(1,000拷贝/μL)以下时,传染性颗粒几乎不能检测到,因此病毒传播的风险很低(La Scola et al., 2020; Quicke et al., 2020; Wolfel et al., 2020)。
人们亟需一种能够识别传染性个体且快速而广泛的SARS-CoV-2检测,这一需求促使人们致力于探索基于CRISPR技术的病毒RNA检测新策略。Cas12和Cas13蛋白是细菌适应性免疫系统的RNA引导成分,它们分别直接靶向单链、双链DNA或单链(ss)RNA底物(Abudayyeh et al., 2016; Chen et al., 2018; East-Seletsky et al., 2016; Zetsche et al., 2015)。Cas13与含有可编码间隔序列的CRISPR RNA(crRNA)结合,形成了一种不激活核酸酶的核糖核蛋白复合物(RNP)。当RNP与互补的目标RNA结合时,它能激活Cas13的HEPN基序(高级真核生物和原核生物的核苷酸结合区域),然后不加选择地切割周围的任何ssRNA。RNP与目标RNA的结合和随后的Cas13裂解活性可通过与ssRNA连接的荧光猝灭剂进行检测,ssRNA在激活Cas13裂解后会发出荧光(East-Seletsky et al., 2016)。
使用细菌诱导细胞休眠以减少噬菌体传播的成功策略(Meeske et al., 2019)现已广泛用于病毒诊断(Chen et al., 2018; East-Seletsky et al., 2016; Gootenberg et al., 2018; Gootenberg et al., 2017; Myhrvold et al., 2018)。为了实现检测的高灵敏度,目前的CRISPR诊断法(CRISPR Dx)依赖于目标RNA的预扩增,以便用于随后的Cas蛋白检测。对于RNA敏感的Cas13蛋白,人们需要通过一系列复杂的方法才能对Cas13a或Cas13b进行检测,这种方法被称为“SHERLOCK”法(Gootenberg et al., 2018; Gootenberg et al., 2017)。该方法最近被用于SARS-CoV-2的检测(Joung et al., 2020b),并进一步发展为用于检测未提取样品的“SHINE”法(Arizti-Sanz et al., 2020)。通过使用DNA敏感的Cas12进行检测,可以避免将扩增的DNA转换回RNA,这种方法称为“DETECTR”法(Chen et al., 2018),最近已用于SARS-CoV-2的检测(Broughton et al., 2020)。SHERLOCK和DETECTR法可以使用适用于即时检测的纸质侧向流动条进行读取,但都需要大约一个小时才能完成,而且目前FDA批准的检测方法仍然是基于实验室的。
在此,我们报道了一种基于CRISPR-Cas13a的快速检测方法并进行了演示,这种方法可直接检测SARS-CoV-2 RNA。与既往的CRISPR诊断不同,这种方法不需要预先扩增病毒基因组即可进行检测。无需进行其他操作,该方法就可以进行定量RNA测量,而不是仅仅得出简单的阳性或阴性结果。为了证明该测定法的简便性和便携性,我们使用小型精简设备的手机摄像头进行了荧光测试,这种设备使用了低成本的激光照明和光学采集器件。因为手机摄像头具有高灵敏度和强连接性,以及GPS和数据处理功能,所以这是一种可以应用到资源匮乏地区的有益工具,有助于即时地诊断疾病(Breslauer et al., 2009; D'Ambrosio et al., 2015; Kamgno et al., 2017; Wood et al., 2019)。通过组合多个crRNA来增强Cas13a的活化并分析荧光随时间的变化(而不是只分析终点荧光),我们能够使用该设备在30分钟的测量时间内检测到约100拷贝/μL的预提取SARS-CoV-2 RNA。我们还可以使用该设备在5分钟内正确识别出所有用于测试的SARS-CoV-2阳性患者的RNA样品(Ct值14.37~22.13)。这种方法或可为即时SARS-CoV-2筛查提供快速、准确、便携的低成本选项。
结果
用Cas13a直接检测并量化新冠病毒RNA
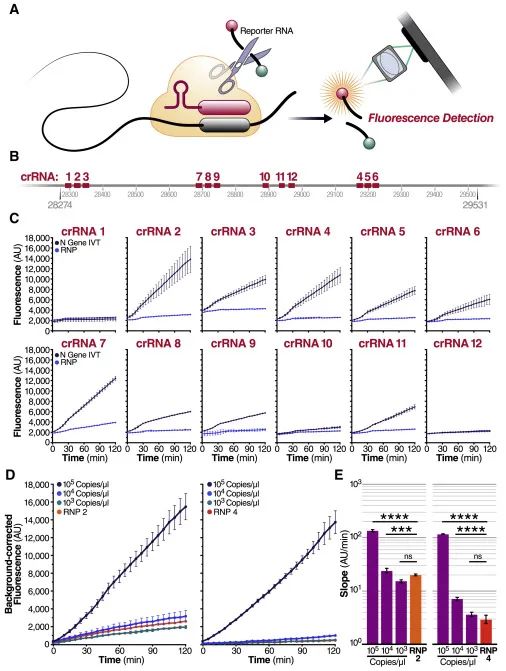
当SARS-CoV-2序列于2020年1月公开时,我们着手开发了一种基于Cas13的病毒RNA直接检测方法,该测定法无需扩增病毒RNA即可进行即时检测。为此,我们需要通过仔细选择合适的crRNA来优化Cas13的激活,并为我们的测定方法开发灵敏度高且便携的荧光检测系统(图1A)。最初,我们根据SARS-CoV-2的N蛋白基因设计了12个crRNA(表S1)。每个Cas13-crRNA RNP都能检测到N蛋白基因中单个长20个核苷酸的区域(图1B)。
在480 fM(2.89 x 105拷贝/微升)的目标RNA浓度下,我们鉴定出了10个具有活性的crRNA。我们在平板读取器上通过直接检测测定法分别测试了每个crRNA,最终选择了两个crRNA(crRNA 2和4)进行后续试验,因为它们对Cas13a活化的作用最大。
接下来,我们对目标RNA进行了稀释,以分别确定每种crRNA的检测限度。LbuCas13a在低至10 fM(约6000拷贝/μL)的目标RNA水平上显示出了可探测到的报告基因裂解,(East-Seletsky et al., 2017)。针对SHERLOCK法的研究曾报道,未进行预扩增的检测限度为约50 fM(Gootenberg et al., 2017)。与此相符的是,我们发现,对于1,000拷贝/μL的体外转录(IVT)目标RNA浓度,使用crRNA 2和crRNA 4制成的RNP似乎不会产生高于RNP对照的荧光信号(图1D)。通过Cas13a直接检测产生的信号似乎与测定中目标RNA的浓度成正比。结果证实,crRNA 2和4均促进了至少10,000拷贝/μL的IVT N基因RNA探测(图1E)。另外,我们证实了Cas13a激活的速率与目标RNA的浓度成比例(图S1B-D)。
组合crRNA可提高Cas13a的敏感性
接下来,我们在同一反应中组合了crRNA,从而形成两个不同的RNP亚群,然后我们评估这种方式能否增强Cas13a的整体活化,从而提高测定的灵敏度。研究发现,crRNA 2和4的结合显著增加了检测反应的斜率和反应的敏感性(图2B)。为了确定crRNA组合如何影响检测限度,我们使用了经过稀释的一系列IVT N蛋白基因RNA对crRNA 2 + 4进行了测试。与无靶标的RNP对照(RNP 2 + 4)相比,crRNA 2 + 4与RNP的组合将检测限提高到至少100拷贝/μL IVT目标RNA(图2C)。我们从SARS-CoV-2感染的Vero CCL-81细胞上清液中分离了病毒RNA并对其进行了相同的测定,发现该测定法可以检测到至少270病毒拷贝/μL的RNA(图2D)。
CRISPR诊断的一个主要优点是它们的高度特异性。为了确认我们的crRNA的特异性,我们使用了一组不同于新冠病毒的呼吸道病毒进行了测试,包括α冠状病毒HCoV-NL63、β冠状病毒HCoV-OC43,以及中东呼吸综合征冠状病毒(MERS-CoV)。我们将crRNA 2和4单独或组合使用于Cas13a直接检测分析时,对于任何测试的病毒RNA,我们都未检测到高于背景RNP的信号(图3A)。
讨论
在此,我们展示了使用CRISPR-Cas13a和手机直接检测SARS-CoV-2 RNA的方法,为快速即时检测提供了一种颇有前景的选项。本研究取得的第一个关键进展是证明了crRNA组合可以通过激活更多的Cas13a(以每个目标RNA计)来提高检测的敏感性。我们的研究表明,两个或三个crRNA的组合可用于探测低至约30拷贝/μL的目标病毒RNA。充分利用靶向基因组不同部分的各种crRNA也可以避免由于自然发生的病毒突变而导致的不完全检测。
本研究取得的第二个关键进展是将荧光信号直接转化为病毒载量的量化。我们设计的方法无需对病毒RNA进行扩增,而是采用直接探测的方法。在这一过程中,我们显示了反应速率与病毒拷贝数直接相关,因而可用于定量分析。结合高频检测,定量数据可能会带来许多益处:可以监测患者感染的病程,确定感染是在增强还是减弱。既往研究提出,有症状感染者中,病毒载量随感染病程的变化而变化(Wolfel et al., 2020)。定量监测病毒载量可以估计患者的感染阶段,且有助于实时预测患者的感染力、恢复力和解除隔离的恰当时机。
本项工作的第三个关键进展是开发了基于移动电话和低成本光学器件的小型显微镜,可用于准确读取Cas13a直接检测的分析结果,在30分钟内可实现约100拷贝/μL的灵敏度;而且,该设备可以在5分钟内准确诊断从患者样品中预先提取的一组RNA。这表明可以构建基于消费电子产品而非专业实验室技术的便携式诊断设备,并与Cas13a分析一起使用。结合对密切接触者的有效跟踪以及上传至云系统的数据,移动便携式SARS-CoV-2诊断程序可以在当前和未来的大流行中发挥重要作用。
虽然我们证明了使用基于现有PCR引物的crRNA可以实现灵敏度较高的快速检测,但我们也希望能系统地搜索整个病毒RNA基因组中最佳的crRNA组合,从而进一步改善该检测手段。随着研究者发现了更多有关病毒变体的信息(Osorio and Correia-Neves, 2020; Vanaerschot et al., 2020),人们可以调整crRNA设计,从而避免假阴性结果。不过,组合crRNA在提高灵敏度的同时也导致意外脱靶的几率升高了。而且,当组合中的一种crRNA与样品中的病毒序列不完全匹配时,只有较低的病毒载量得到了记录。未来的研究有望进一步改进报告基因、Cas13蛋白的选择,以及探测装置和摄像头的感光度。这些进展或许能提高反应速率,从而可以在较短的时间内提高检测的精度和检测限度。

最近一项针对超过19,000多名受访者的全国调查显示,基于鼻拭子的qPCR测试结果的平均等待时间为4.1天,其中31%的检测耗费4天以上,而10%的测试耗费10天或更长时间(Lazer et al., 2020)。处理这些实验室检测的国家积压工作清楚地突出了我们对快速即时检测的需求。由于自然感染或疫苗接种产生的长期免疫力可能会在2-4个月内下降(Ibarrondo et al., 2020; Long et al., 2020),因此对新冠病毒的快速高频检测需求可能会持续存在。在未来,我们在此提出的Cas13a直接检测方法可以迅速进行调整,服务于下一种可能暴发的呼吸道病原体检测,希望能够及时遏制传染性疾病在全球范围内的扩散。

相关论文信息
原文刊载于CellPress细胞出版社旗下期刊Cell上
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy
▌论文网址:
https://www.cell.com/cell/fulltext/S0092-8674(20)31623-8#figures
▌DOI:
https://doi.org/10.1016/j.cell.2020.12.001
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




