- +1
观森见木:肾癌单细胞图谱揭示免疫治疗抵抗与肿瘤进展的关联
原创 Cell Press CellPress细胞科学
 生命科学Life science
生命科学Life science肾透明细胞癌(ccRCC)的患者间及个体内异质性会干扰肿瘤治疗方法及生物标志物的探索。2021年4月15日,Cell Press细胞出版社期刊Cancer Cell发表了来自斯隆凯特琳癌症中心(Krishna et.al)与丹娜法伯癌症研究所及博德研究所(Braun et al., Bi et al.)的几份研究报告:通过单细胞转录组测序数据来描述与肾透明细胞癌进展及免疫治疗抵抗相关的渐进性免疫功能障碍。
Cell Press细胞出版社微信公众号对该论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望文。
肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是最常见的肾癌亚型,也是免疫及血管浸润性水平最高的癌症类型之一(Senbabaoglu et al., 2016)。因此,单独给予免疫检查点阻断剂(immune checkpoint blockade,ICB)或与抗血管生成的酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs)联用可以改善ccRCC的治疗前景(Xu et al., 2020)。尽管ICB可以为响应者提供持久的助益,大多数患者仍会发生自发或获得性治疗抵抗,这种治疗抵抗的机制尚未可知。ccRCC具有高度异质性,在肿瘤微环境(tumor microenvironment,TME)中,肿瘤细胞及其他细胞的构成及转录组表现出极高的个体内及患者间差异,对肿瘤进展及治疗抵抗有一定影响。这种异质性对于鉴定更有效的ccRCC治疗靶标及预测响应水平的生物标志物产生了干扰。虽然常规二代测序具备一定的分辨率,但在理解特定细胞类型如何介导治疗起效的作用机理上仍然受到分辨率的局限(Motzer et al., 2020)。相比之下,单细胞转录组测序(single-cell RNA sequencing,scRNA-seq)能够对细胞构成及转录状态进行全面的刻画,从而对细胞状态间的连续转变、细胞间多种相互作用及这些事件对肿瘤进展及治疗响应影响提供重要的见解。本文重点介绍三项新研究,这些工作提炼了ccRCC进展及ICB治疗响应的关键事件,为理解ccRCC复杂免疫及细胞图景提供了必要的清晰度。
在Braun et.al的研究中,研究者团队对13例各期别ccRCC患者来源的癌及癌旁组织中的免疫细胞进行了scRNA-seq和T细胞受体(TCR)测序,以确定浸润性免疫细胞随疾病进展的变化(Braun et.al, 2021)。这些数据主要显示了一种线性的演化轨迹,该轨迹与晚期肿瘤中渐进性的T细胞功能障碍或耗竭以及TCR多样性降低相关(图1)。类似的,早期肿瘤中的巨噬细胞显示出较高的M1型基因特征表达,而晚期及转移性肿瘤中的巨噬细胞则表现了较高的M2型基因特征表达。此外,尽管早期肿瘤中大多数T细胞被预测具有较少的细胞间交互作用,终末耗竭性CD8+T细胞则被预测出与单核细胞和巨噬细胞之间存在许多的相互作用。事实上,终末耗竭性CD8+T细胞与转移性肿瘤中最为富集的髓系细胞群之间,共有77种显著的配体-受体可鉴别交互作用,这些交互作用可能是改善晚期ccRCC的抗肿瘤免疫的潜在治疗靶标。此外,一种代表终末耗竭或肿瘤相关巨嗜细胞(tumor-associated macrophage,TAM)交互作用的基因表达特征随肿瘤进展升高。该特征与癌症基因组图谱中肾透明细胞癌(The Cancer Genome Atlas Kidney Renal Clear Cell Carcinoma,TCGA KIRC)所有分期中的总体生存率下降相关,但与PD-1阻断剂及mTOR抑制剂的治疗响应水平无关。这提示了这些细胞间交互作用可能驱动ccRCC进展,却不能决定治疗的响应水平。
为了确定ICB对免疫微环境的影响,Krishna等研究者对2位未经ICB治疗及4位经ICB治疗的患者队列进行了配对的scRNA-seq和TCR测序,对来自多个肿瘤区域、淋巴结、邻近正常肾脏组织以及外周血中的细胞进行取样分析(Krishna et al., 2021)。研究者观察到在ICB治疗及未治疗组的患者个体内及个体间,T细胞与TAM的表型多样性以及免疫异质性具有显著的差异。该发现再次说明了因肿瘤采样部位偏差使经典二代RNA测序来源的分子表型具有很大差异。值得注意的是:ICB治疗的患者组织内常富集CD8A+T细胞群体,有一名完全响应患者所有肿瘤灶中TAM的浸润水平都很低;然而在ICB抵抗的患者中,原发肿瘤灶及淋巴结转移部位均主要有TAM的广泛浸润,从而降低了T细胞浸润水平。经病理检查,在未经治疗的患者体内,这些细胞群分别与肿瘤转归及肿瘤分级相关,也就是说,发生完全转归的肿瘤灶部位被大量的CD8A+T细胞、CD4+T细胞及NK细胞所浸润,而免疫抑制性TAM群体主要是在无转归的高级别肿瘤灶区域占据主导。组织驻留CD8A+T细胞高表达可作为生物学标志来预测IMmotion 151及Javelin Renal 101(ICB+TKI联用组)临床试验队列中无进展生存期的改善,但是这一标志与TCGA KIRC的生存期延长无关,表明这群细胞可能特异性地作用于ICB治疗响应。值得注意的是,肿瘤内扩增最广泛的TCR克隆类型也能在其他肿瘤区域内被找到(该现象与肺癌中发现的区域特异性TCR扩张相反),并在外周血单核细胞(peripheral blood mononuclear cells,PBMCs)以及癌旁肾脏组织中也可检测到,这提升了以分析PBMCs TCR抗体文库为工具来监测ICB响应水平的应用潜力。
在一项对5位经ICB治疗及3位未经治疗的转移性RCC患者的类似研究中,Bi等研究者鉴定了低表达活化标记物4-1BB(4-1BB-Lo)的CD8+T细胞,而该群细胞此前与黑色素瘤患者的预后改善相关(Bi et.al)。Bi等研究人员发现,经ICB治疗后,只有4-1BB-Lo细胞可上调许多共刺激分子及趋化因子。此外,Checkmate 009队列中接受纳武单抗治疗患者的疗程中样本的4-1BB-Lo表达特征显著增加,表明4-1BB-Lo细胞可能存在,且在暴露于ICB时产生反应并分化。然而,该群细胞的基因表达变化表明细胞可能更趋于终末耗竭的状态,从而提供了产生治疗抵抗的途径(图1)。在TAM及单核细胞群中,ICB的暴露与促炎表型相关,这种转变在ICB应答者中尤甚,并可能受CD8+T细胞产生的干扰素所诱导。矛盾的是,暴露于ICB也与CD8+T细胞免疫检查点及巨噬细胞抗炎信号基因的显著上调相关。因此,尽管应答者的TAM具有促炎表型——类似于4-1BB-Lo细胞——它们也表现出可能最终导致对ICB产生抵抗的表达变化。在肿瘤细胞中,有一簇细胞高表达调节肾脏形态发生及血管生成的基因集(TP1簇),这簇细胞的存在与Checkmate 025纳武单抗队列中显著改善的总体生存率相关,与此同时根据基因表达推测出的4-1BB-Lo细胞丰度也有所增加。这佐证了肿瘤TP1表达程序及肿瘤-免疫细胞交互作用介导的患者生存之间的关系。相比之下,TP2簇以代谢可塑性相关基因为特征,其免疫检查点及免疫逃逸基因发生上调,这些基因与Checkmate 025纳武单抗治疗队列生存率降低相关,同时该群细胞与CD8+T细胞及TAM之间推测的抑制性交互作用有所增加。
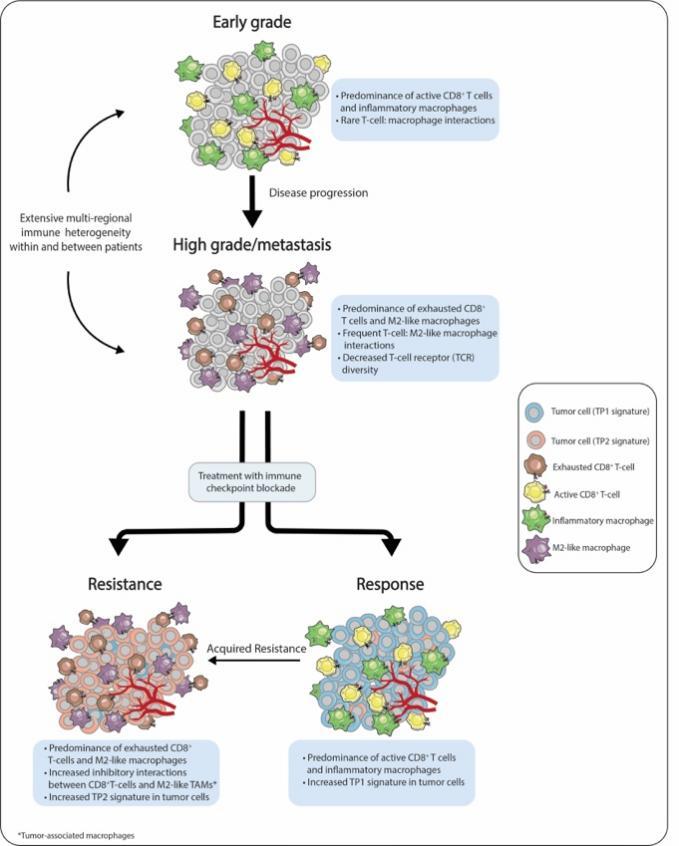 图1:ccRCC进展及治疗抵抗相关的免疫微环境变化。低级别ccRCC以富含促炎M1型肿瘤相关巨嗜细胞(tumor-associated macrophages, TAM)和具有正常功能的CD8+T细胞群体为主要特征。而高级别及转移性的肿瘤中显示出抑炎M2型TAM及耗竭性CD8+T细胞的富集。ccRCC的肿瘤具有高度异质性,单个肿瘤组织中同时具有局灶性的高级别及低级别区域。经免疫检查点阻断剂(immune checkpoint blockade, ICB)治疗后,治疗响应的患者肿瘤中促炎TAM、功能性CD8+T细胞以及具有TP1基因表达特征的肿瘤细胞有所增加,而治疗抵抗患者来源的肿瘤中富集了抑炎M2型巨噬细胞、耗竭性CD8+T细胞及TP2基因表达特征的肿瘤细胞。治疗响应者体内的促炎TAM及功能性CD8+T细胞也同时上调了与免疫逃逸相关的基因,为最终发生治疗抵抗提供了一条途径。
图1:ccRCC进展及治疗抵抗相关的免疫微环境变化。低级别ccRCC以富含促炎M1型肿瘤相关巨嗜细胞(tumor-associated macrophages, TAM)和具有正常功能的CD8+T细胞群体为主要特征。而高级别及转移性的肿瘤中显示出抑炎M2型TAM及耗竭性CD8+T细胞的富集。ccRCC的肿瘤具有高度异质性,单个肿瘤组织中同时具有局灶性的高级别及低级别区域。经免疫检查点阻断剂(immune checkpoint blockade, ICB)治疗后,治疗响应的患者肿瘤中促炎TAM、功能性CD8+T细胞以及具有TP1基因表达特征的肿瘤细胞有所增加,而治疗抵抗患者来源的肿瘤中富集了抑炎M2型巨噬细胞、耗竭性CD8+T细胞及TP2基因表达特征的肿瘤细胞。治疗响应者体内的促炎TAM及功能性CD8+T细胞也同时上调了与免疫逃逸相关的基因,为最终发生治疗抵抗提供了一条途径。综上所述,这些研究揭示了构成复杂TME的细胞异质性、可塑性及互作性,同时确定了共通的线索:每项研究都报道了耗竭性或功能失调的CD8+T细胞及抗炎的M2型TAM与肿瘤进展及ICB治疗抵抗相关,而且具有正常功能的CD8+T细胞及促炎型TAM与肿瘤转归及ICB响应相关。这些研究在强化已知主题的同时,也揭示了细胞状态的连续变化,并鉴别出新的可能影响肿瘤整体免疫“温度”的基因特征及分子靶标。这些研究主要局限于采用体量相对较小的患者队列来生成这些特征。尽管这些被鉴定出的特征的预后及预测价值已在多个外部队列中得到验证,仍需进一步的研究工作来确定患者共有的治疗靶标,或可解决现有治疗方法耐受的问题。此外,进一步分析其他尚未被充分研究的免疫细胞类型——例如肿瘤内抗原提呈部位的细胞——的研究,将对鉴定新型治疗靶点从而解决ccRCC免疫功能障碍这一问题至关重要(Jansen et al., 2019)。
参考文献
Bi, K., He, M., Choeiri, T., and Van Allen, E. (2021). Tumor and immune reprogramming during immunotherapy in advanced renal cell carcinoma. Cancer Cell.
Braun, D., Street, K., Burke, K., Cookmeye, D., Choueiri, T., and Wu, C. (2021). Progressive immune dysfunction with advancing disease stage in renal cell carcinoma. Cancer Cell.
Jansen, C. S., Prokhnevska, N., Master, V. A., Sanda, M. G., Carlisle, J. W., Bilen, M. A., Cardenas, M., Wilkinson, S., Lake, R., Sowalsky, A. G., et al. (2019). An intra-tumoral niche maintains and differentiates stem-like CD8 T cells. Nature 576, 465-470.
Krishna, C., DiNatale, R., Chan, T., and Hakimi, A. (2021). Single cell sequencing links multiregional immune landscapes and issue resident T cells in ccRCC to tumor topology and therapy efficacy. Cancer Cell.
Motzer, R. J., Banchereau, R., Hamidi, H., Powles, T., McDermott, D., Atkins, M. B., Escudier, B., Liu, L. F., Leng, N., Abbas, A. R., et al. (2020). Molecular Subsets in Renal Cancer Determine Outcome to Checkpoint and Angiogenesis Blockade. Cancer Cell 38, 803-817 e804.
Senbabaoglu, Y., Gejman, R. S., Winer, A. G., Liu, M., Van Allen, E. M., de Velasco, G., Miao, D., Ostrovnaya, I., Drill, E., Luna, A., et al. (2016). Tumor immune microenvironment characterization in clear cell renal cell carcinoma identifies prognostic and immunotherapeutically relevant messenger RNA signatures. Genome Biol 17, 231.
Xu, W., Atkins, M. B., and McDermott, D. F. (2020). Checkpoint inhibitor immunotherapy in kidney cancer. Nat Rev Urol 17, 137-150.
 相关论文信息
相关论文信息论文原文刊载于CellPress细胞出版社旗下期刊Cancer Cell上,点击“阅读原文”查看论文
▌论文标题:
Single-cell sequencing links multiregional immune landscapes and tissue-resident T cells in ccRCC to tumor topology and therapy efficacy
▌论文网址:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(21)00165-3
▌DOI:
https://doi.org/10.1016/j.ccell.2021.03.007
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




