- +1
斯坦福大学科学家连发两篇重磅论文,找到让伤口不留疤痕愈合的方法
斯坦福大学科学家连发两篇重磅论文,找到让伤口不留疤痕愈合的方法 原创 生物世界 生物世界

撰文 | nagashi
编辑 | 王多鱼
排版 | 水成文
在自然界中,损伤后修复对个体生存至关重要,一些无脊椎动物(例如蚯蚓)和低等脊椎动物(例如壁虎),它们一生中都具有强大的再生能力,即使遭遇断肢等伤害也能在一段时间后修复如初。
然而,而对于人类而言,伤口通常会通过形成纤维化疤痕而愈合。这种疤痕如果出现脸、脖子等裸露在外的部位,就会严重影响人的外貌,还可能导致人出现自卑等负面情绪。
长期以来,在受伤后预防疤痕形成,实现功能组织再生,是组织修复梦寐以求的目标。然而,不幸的是,直到现在,疤痕形成的具体分子机制仍有待阐明。
2021年9月1日,斯坦福大学医学院 Michael Longaker 等人在 Science 子刊 Science Translational Medicine 上发表了题为:Jun promotes hypertrophic skin scarring via CD36 in preclinical in vitro and in vivo models 的研究论文。
该研究发现,一种转录因子——Jun,是病理皮肤疤痕的关键调节因子,它通过调节CD36启动纤维化,促进增生性皮肤疤痕形成。因此,研究人员表示,阻断Jun下游的CD36将可能可以阻止皮肤疤痕的形成。

病理皮肤疤痕及其后遗症是一个巨大的经济和医疗负担。仅在美国,每年都有超过1亿个新的疤痕作为对皮肤损伤的生理反应,由此产生的纤维化疤痕组织在形式和功能上都有异常,并有可能导致毁灭性的毁容和永久性的功能丧失。
有趣的是,随着年龄的增长,伤口的愈合也越来越困难,从胎儿的无疤痕愈合,到产后健康皮肤的正常疤痕,再到增生性瘢痕的过度疤痕。目前还没有有效的分子疗法来预防或逆转疤痕。因此,阐明介导疤痕形成的关键机制是十分必要的。
早在今年4月,本研究的通讯作者 Michael Longaker 及其团队在 Science 期刊发表的题为:Preventing Engrailed-1 activation in fibroblasts yields wound regeneration without scarring 的研究论文发现,特定的皮肤成纤维细胞群体能够响应伤口的局部组织力学,激活Engrailed-1(En1)的表达并开启纤维化细胞程序。因此,抑制成纤维细胞中Engrailed-1(En1)的激活可以阻止疤痕形成。
在机体中,成纤维细胞主要负责皮肤再生和修复。研究团队最近也证实,转录因子Jun是小鼠和人类多个器官中系统性疤痕形成的关键驱动因素。Jun是是异源二聚体转录因子AP-1的主要组成部分,主要在成纤维细胞中表达,成纤维细胞对Jun表达有选择性的响应。
在这项研究中,研究团队利用肥厚性疤痕(HTS)小鼠模型和人类疤痕(hSc)来源的成纤维细胞,探讨了Jun促进皮肤疤痕形成的分子机制。
肥厚性疤痕(HTS)小鼠的α-平滑肌或Ⅰ型胶原表达细胞过表达Jun,导致这种小鼠的皮肤成纤维细胞在皮肤损伤后过度沉积细胞外基质。研究人员发现,Jun过表达通过调节伤口内不同的成纤维细胞亚群、增强网状成纤维细胞数量和减少脂成纤维细胞,从而触发真皮纤维化。

Jun过表达诱导疤痕形成
对人类疤痕(hSc)来源的成纤维细胞的分析进一步显示,Jun在疤痕中广泛高表达,包括肥厚性疤痕和疤痕疙瘩。与之相对,通过CRISPR-Cas9技术敲除人肥厚性疤痕(HTS)成纤维细胞中的Jun基因,并结合人类和小鼠HTS成纤维细胞的表观基因组学和转录组学分析显示,Jun通过调节CD36来启动纤维化。

Jun上调网状成纤维细胞的纤维化信号通路
不仅如此,研究团队还发现,用丹参的有效水溶性成分——丹酚酸B可以阻断CD36来抵消Jun介导的人类成纤维细胞和小鼠创伤的纤维化。此外,敲除CD36也可以达到类似的效果。
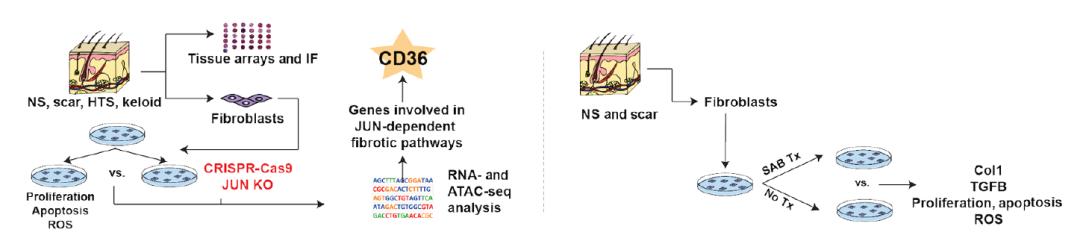
抑制CD36可以降低Jun依赖的皮肤疤痕形成
综上所述,这项研究提供了一个皮肤疤痕形成的转录组学和表观基因组学特征,并证实了,转录因子Jun是病理性皮肤疤痕形成的关键调控因子。基于这些发现,靶向其下游效应因子CD36可能代表了一种全新的、抗疤痕形成的治疗策略!未来相关的研究或将催生出治疗病理皮肤疤痕的治疗药剂,为“伤痕患者”带来福音!
论文链接:
https://www.science.org/doi/10.1126/scitranslmed.abb3312
https://science.sciencemag.org/content/372/6540/eaba2374
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




