- +1
腹部双能量CT定量技术(上)
腹部双能量CT定量技术(上) 原创 赵喜同学 XI区 收录于话题 #双能量 46个内容
大家好,欢迎大家访问XI区!
双能量CT(DECT)通过使用两种不同的X射线光谱,同时或接近同时地获取两个不同的数据集,从而获得更多的信息。光电效应和康普顿散射之间的微妙平衡是决定DECT扫描模式的关键因素,与传统的X射线和混合能量CT(SECT)技术类似。CT值是多种因素(例如,光子能量、质量密度)的函数。当使用SECT时,不同元素组成的材料可能会表现出类似的CT值,并可能无法区分彼此。这是SECT的一个固有限制。DECT克服了这一障碍,它在第二能级上获取衰减系数,从而允许随后对特定材料进行分解并最终进行量化分析。因为通过光电效应发生相互作用的可能性与目标组织的原子序数和密度成正比,由此产生的不同的能量谱能够识别、提取和量化目标材料。
早期的DECT扫描原型有很大的技术局限性,即两种能量之间存在高度的空间和时间错位、高噪声和辐射剂量增加。然而,在过去的10-15年里,CT球管和探测器技术的快速发展为临床DECT系统的诞生提供了条件,重新激发了影像医学界对这项技术的兴趣。
DECT为许多诊断问题提供了定性和定量的解决方案。定性分析使用各种能量和材料的特定数据集,在每个体素的基础上直观地评估材料含量。定量分析更进一步,允许用户在图像数据上画出感兴趣的区域,以生成特定的材料测量值,如碘浓度。
虽然是创新,但定量DECT还没有达到普遍的临床实践,主要是由于供应商特定的硬件和软件包不容易相互适用。
以下文章中涉及的许多内容确实是实验性的。然而,随着DECT在临床上获得更多的发展,全面了解常用的定性和有希望的定量应用,也能让放射科医生认识并欣赏这种诊断工具。它还能使放射科医生发现更多的DECT适应症,并可能将CT诊断的边界推向未被发现的前沿领域。下面我们通过回顾腹部和盆腔的图像显示、量化技术和临床应用,对DECT的定量应用进行概述。
DECT数据的效用
在过去的30年里,CT扫描仪技术的飞跃使DECT成为一种更易于临床使用的工具。20世纪80年代发布的改良型商业CT系统(Somatom DR;西门子医疗, Erlangen, Germany)是首批应用于临床的DECT系统之一。该扫描仪使用一个单一的X射线管,在高能和低能的潜在能量之间快速切换,但最终因特定能量数据集之间的噪声水平不同而受到影响。
2006年,一种双源DECT扫描仪(SOMATOM Definition; 西门子医疗, Erlangen, Germany)问世,它将两个X射线源和两个探测器安装在同一个机架上。第一代双源具有83ms的时间分辨率、可调节的特定能级噪声水平和光谱过滤优化。
在过去的十年时间里,DECT在多厂商产品的开发和临床应用方面经历了一个快速上升期。与传统的SECT相比,重建不同的DECT材料或能量的数据集提供了大量的图像显示新意。这些独特的优势包括改进病变检测和分类、腹部偶发肿瘤的定性,从而放弃或减少后续检查的需要、潜在的辐射剂量降低和成本节约,以及改善图像质量。定量DECT,即由碘定量和理想的供应商中立的CT值测量驱动,可以催化这种进步,并填补其他方式留下的空白。然而,应该注意的是,许多研究报告称,不同供应商平台的CT值测量存在差异,目前是限制临床广泛采用的一个因素。
腹部偶发肿瘤
SECT的一个常见限制是对腹部偶发肿瘤的完整描述。这种情况往往需要安排单独的影像检查对有关的偶发肿瘤(如肾上腺或肾脏病变)进行全面评估。采用精简的DECT后处理技术和重建,在最初发现时就为病变特征提供了方便和全面的评估途径,从而放弃了对未来随访检查的需要。这种好处还辅以改善成本效益评估和降低辐射剂量的潜力。例如,在评估偶然发现的尺寸≤4cm的不确定的肾脏病变时,单期DECT比多期SECT和MRI更具成本效益。
肿瘤
DECT可以优化目前基于尺寸的肿瘤分类系统,后者未满足临床需求。这些系统在描述肿瘤增强变化与治疗反应方面历来不足,特别是随着抗血管和免疫抑制剂治疗恶性肿瘤,如黑色素瘤或胃肠道间质瘤,的日益普及和有效。DECT提供了一个不同的角度来观察这些治疗方案后肿瘤的反应,它承认既定的基于尺寸的肿瘤指标,但也同时提供与肿瘤血管和实质成分有关的生存能力的定量和定性评估。
肝脏疾病
肝脏脂肪变性和纤维化的定量和分级主要是用MR进行。例如,质子密度脂肪分数(PDFF)是基于成像的脂肪含量测量的标准,但除非扫描协议包括多回波化学转换脉冲序列,否则通常无法使用。尽管在平扫图像上使用线性衰减系数测量对严重的脂肪变性定量显示出良好的特异性,但SECT在测量轻度至中度患者的肝脏脂肪含量时并不精确。由于平扫图像不是大多数CT检查采集方案的一部分,因此这一局限性进一步加剧。使用传统的SECT进行肝脏脂肪定量的障碍在增强CT检查中甚至更大。
新的数据表明,DECT可能能够对肝脏脂肪含量进行准确的无创分级,并为偶然的筛查和量化提供机会。
定量DECT图像重建和显示技术要点
有效的DECT定量成像需要对基本的数据采集和临床上有意义的解释所需的成像重建有基本的了解。重建可由特定材料或能量的CT数据集产生,两者都需要指定的材料分解后处理算法。DECT数据可以在重建高能量或低能量图像之前(原始数据或投影空间域)或之后(图像空间域)进行后处理。选择投影空间分解还是图像空间分解,完全取决于所采用的DECT硬件类型。例如,投影空间分解用于kV快速切换或双层探测器CT平台。相反,图像域分解则用于双源CT系统。图像和投影数据相关内容,参见:。
DECT检查产生大量的成像数据,历来需要高水平的放射科医生和技术员的专业知识来指导PACS的无缝整合。可以使用几种工作流程的算法(下图)。传统的DECT重建主要发生在一个独立的后处理工作站。成像采集后,用户为特定的检查和临床场景手动生成所需的重建。随后,图像被推送到PACS进行进一步审查。
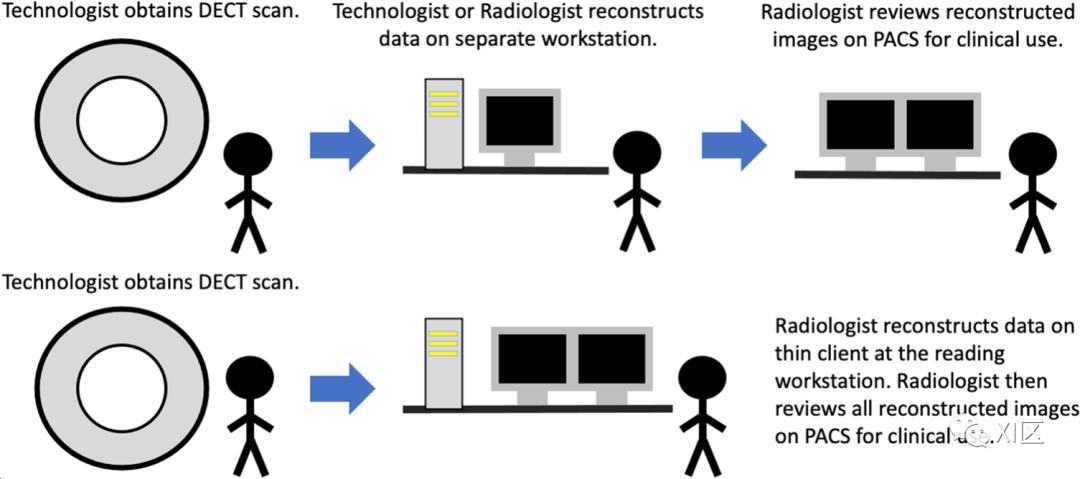
DECT采集和重建工作流程--不同的DECT工作流程算法可以在临床实践中实施。传统上,技术员获取DECT扫描,并将原始数据传输到供应商指定的工作站(上排)。该工作站可以放置在用户选择的位置。然后,技术员或放射科医生对任何需要的数据集进行手动后处理,并将其转发到PACS。然后放射科医生在诊断工作站对检查进行解释。或者,技术员可以将原始数据发送到供应商特定的瘦客户端服务器(下排)。这通常安装在放射科医生进行诊断性阅读的同一台电脑上。放射科医生在瘦客户端上对数据进行后处理,并将所有完成的数据转发给PACS进行最终解释。
这种方法的自动化程度最低,而且受限于用户必须运用高水平的特定扫描仪知识来有效重建有用的数据。尽管如此,基于工作站的重建方法拥有DECT重建的全部可能性和创造性。目前,大多数重建解决方案都是利用供应商特定的瘦客户端。原始图像从扫描仪或PACS发送到瘦客户端上。放射科医生在与PACS相同的电脑上连接到瘦客户端,创建感兴趣的系列。鉴于放射科医生可以使用同一台电脑进行所有的检查工作,理论上有节省时间的优势。但是,陡峭的学习曲线可能会限制这种工作流程的选择。另外,重建可以直接在CT扫描仪上生成,并发送至PACS。这个方案将责任转移到了技术员身上。最终,技术员可能在每次检查中花费更多的时间。放射科医生在寻找最有效的重建工作流程时,必须权衡各种因素,如成像数量、放射科医生和技术员的需求以及其他资源。
材料分解是DECT数据在每个体素基础上提取特定材料信息的方法。市面上的DECT扫描仪采用了两种类型的材料分解算法:分别是双材料分解和三材料分解。采用原始数据或投影空间域的双材料分解法,假定一个体积由两种预先确定的材料以二进制组合(如碘和水)组成。鉴于每种材料在两个不同的能量水平上的衰减特性,可以计算出其中一种材料的比例。这个过程取决于材料的原子数和质量衰减系数。具有近乎相同的光谱特性的材料将产生视觉上相似的特定材料图像,在临床上可能不实用。在临床实践中,碘和水最常构成材料基对,用于重建特定材料的图像(例如,碘密度图像)。
采用图像空间域的三材料分解法,假定一个体积由三种材料组成。质量守恒定律和完整性假设指出,体素内的总质量必须等于在基础集中预选的三种材料的所有单个质量分数之和。非脂肪软组织、脂肪和碘构成了腹部成像DECT应用中最常采用的材料基础三要素。不管是实施双材料还是三材料分解,都可以确定预选材料(如碘、脂肪、钙)的直接定量(单位:毫克/毫升)或分数百分比。
选择碘作为材料基础成分是相当有效的,因为它可以从特定材料的图像中减去,从而产生虚拟平扫图像,或者用用户可定制的彩色编码梯度叠加到灰度图像上,从而产生一个碘的叠加图像。材料分解还允许创建碘图。碘图可以用来测量感兴趣的特定区域的碘含量。
除了特定材料的数据集形成和量化外,DECT还可以进行特定能量的重建。SECT利用多色的X射线束来提取传统的诊断信息。与SECT相比,DECT的一个主要优势是能够合成虚拟的单色(也被称为 "单能量")数据集。这些数据集克服了多色X射线光谱的内在限制--即低能量光谱中普遍存在的高对比度和高噪声,而高能量光谱中则存在低噪声和低对比度。多色图像极易受到能量转移现象的影响,如线束硬化伪影,其变化是CT值变化和差异性碘对比的函数。单色X射线光束允许从单个选定的能量(在40-190 keV范围内)的优先光子吸收,并可以为给定的任务优化图像噪声和对比度特征。这样一来,单能数据就用千电子伏特(keV)而不是千伏峰值(kVp)来描述。
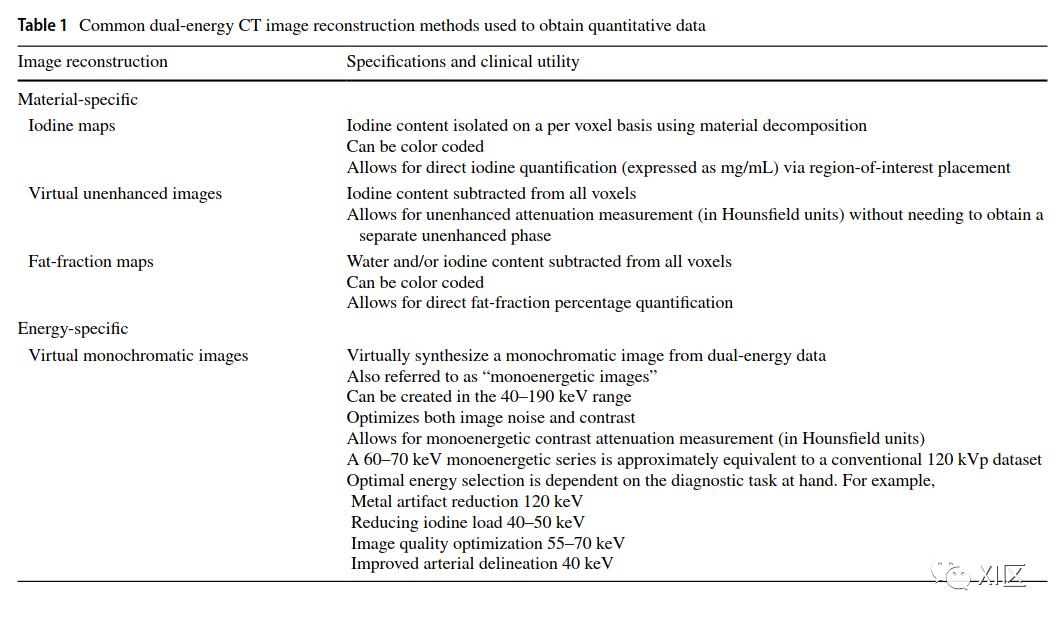
碘造影剂表现出与单色数据的线性对比度衰减。碘造影剂在较低的能量水平(如40keV)下达到最大,并随着能量水平的提高而线性下降。然而,低能量的单色光束会受到更高的噪声影响,对于某些诊断任务来说,不一定理想。此外,由于反相关噪声等影响,单能量数据可能显示出供应商特定的噪声特征。因此,大多数文献建议使用中间范围的能量(即大约60-70 keV的病变检测),以最大限度地提高与噪声的对比度。同样,最理想的能量水平可能取决于诊断任务。最近推出的第二代单能量图像(称为Monoenergetic Plus[Mono +;Siemens Healthineers, Forchheim, Germany])克服了第一代算法的非线性噪声曲线依赖性的限制,可能为DECT定量应用提供更大的机会。这种算法使用空间频率分割技术,将低能量数据的最佳信号与中能量数据的降噪数据结合起来(更多内容参见:)。表1总结了用于腹部定量分析的最常见的DECT重建。
定量DECT消化系统应用
脂肪肝
非酒精性脂肪肝(NAFLD)是目前慢性肝病的主要诱因,大约20%的患者在10年内会发展成肝硬化。因此,早期识别和量化肝脏脂肪对于降低肝病相关的发病率和死亡率至关重要。
通常肝脏活检被认为是肝脏脂肪定量的金标准,但其固有的侵入性和取样依赖性导致了非侵入性成像技术的发展,以取代活检。MR PDFF是评估脂肪肝患者的临床标准,但由于需要前瞻性地纳入MR检查采集方案而受到挑战。CT平扫对中重度脂肪肝具有良好的特异性,阈值为40-48HU,但对轻度脂肪肝缺乏敏感性,几乎从未作为常规临床CT方案的一部分进行采集。最近,人们研究了使用增强SECT来估计肝脏脂肪变性。自动化的肝脏体积分割可以客观评估肝脏脂肪变性,尤其是中度(≥15%)脂肪变性,但该技术仍需要跨厂商验证。
DECT几乎可以从任何增强检查中提供肝脏脂肪含量的估计,克服了MR PDFF和CT平扫在前瞻性方案选择方面的限制。DECT利用了脂肪在高、低能量下的不同衰减。由于康普顿散射相互作用占主导地位,脂肪在较高的能量水平上显示出衰减增加。在较低的能量下,光电效应占主导地位,由于脂肪的有效原子数较低,其衰减较低。脂肪定量可以使用双物质分解法,将脂肪和其他正常的肝脏组织定义为基础对,或者使用三物质分解法,将脂肪、肝脏组织和第三种物质(如碘)作为基础三物质。已发表的研究建议使用 "ΔHU"(即140keV时的肝脏衰减减去80keV时的肝脏衰减之差)或肝脏脂肪分数(即使用材料分解算法计算感兴趣体素内的脂肪百分比)。根据目前可用的数据,DECT可以可靠地检测和量化脂肪变性等级,主要是在增强CT检查中,而增强CT检查占了大部分CT检查。通过kV快速切换DECT进行肝脏脂肪定量的多物质分解分析,与MR光谱和增加组织学脂肪变性等级有很好的相关性。例如,Hyodo及其同事证明,DECT衍生的脂肪体积分数(FVF)和MR衍生的脂肪分数都随着组织学脂肪变性等级的增加而增加。
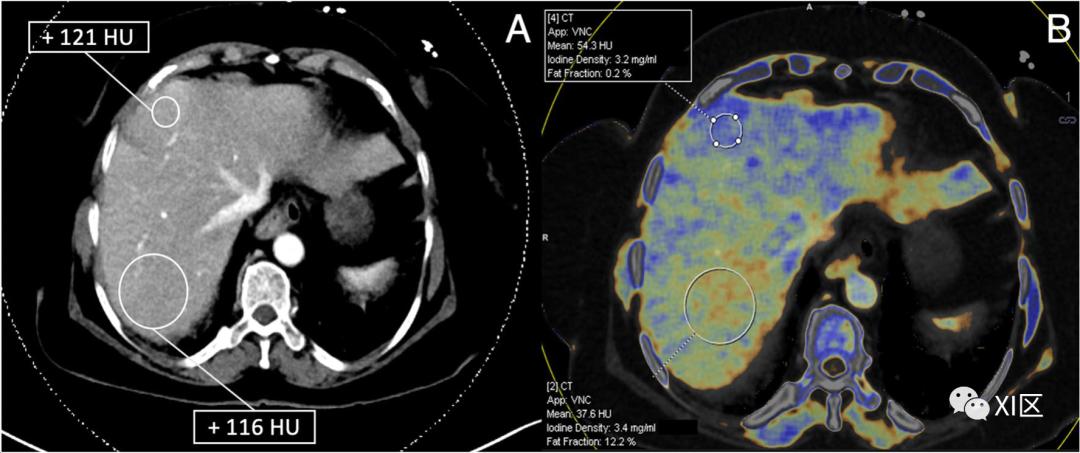
使用双能量CT进行肝脏脂肪定量--使用双或三材料分解,可以提取感兴趣区域内每一体素的脂肪分数。请注意,与混合能量CT不同,获得这一测量结果不需要单独的平扫阶段。在这个例子中,混合(120 kV常规等效)图像划出的衰减值从后段的+116 HU到前段的+121 HU(a),排除了精确的脂肪变性评估的可能性。相应的脂肪分数颜色图显示了肝脏内脂肪分布的异质性。前段的脂肪分数被测量为0.2%,表明脂肪分布正常。然而,后段的脂肪分数显示为12.2%,表明轻度脂肪变性(b)。
肝脏纤维化
肝脏纤维化是肝硬化的标志,有助于决定慢性肝病的临床结果和发展为肝细胞癌的风险。早期检测肝纤维化已被证明可以阻止肝病的发展,甚至有可能逆转肝损伤。肝纤维化的金标准是活检。然而,无创肝纤维化分期对慢性肝病患者来说也至关重要,否则他们将接受连续的有创活检,并出现不可忽略的并发症。已有的测量肝脏硬度的无创成像技术包括超声引导下的瞬时弹性成像或剪切波弹性成像,以及MR弹性成像。这些技术在肝脏纤维化的工作中已相当普遍。然而,采用这些技术的一个实质性问题是需要前瞻性地安排病人进行专门的检查,或者需要特定的协议或人员来使用该技术。在这种情况下,DECT的主要优势是对可能的任何高容量、非前瞻性设计的CT检查进行定量分析。
越来越多的证据支持将DECT用于肝脏纤维化的定量分析。值得注意的是,慢性肝病的特点是细胞外体积增加,主要来自血管外和细胞外空间的胶原蛋白沉积。增强DECT扫描的碘密度测量已被证明可以无创地对肝脏纤维化进行分期并估计细胞外体积。Δ肝,即肝脏平衡期和平扫期衰减与主动脉衰减的差异,已被证明与活检后METAVIR肝脏纤维化评分相关。从平衡期碘密度图像中计算出的细胞外体积,并将其归一化为肝上下腔静脉血池以估计纤维化程度,显示出良好的组织病理学相关性。类似的工作是用平衡期碘浓度归一化的主动脉来估计细胞外体积,显示出与METAVIR评分的良好相关性,但未能区分无纤维化(F0疾病)和极早期纤维化(F1疾病)。目前,如果同时存在脂肪浸润,基于DECT的纤维化定量表现不佳,这可能是现有材料分解算法的反映。目前还不知道铁的共存或多时态测量碘浓度如何影响DECT肝纤维化估计的性能。
铁定量
肝脏铁沉积的增加是慢性肝病的一个显著特征,包括非酒精性脂肪肝、慢性病毒性肝炎和血液病相关贫血。它还与纤维化、肝硬化、肝细胞癌和心脏不良后遗症的风险增加有关。而血浆或血清铁蛋白定量被认为是评估血色素沉着的最常用测试,作为肝脏储存的代用指标,它也是一种急性期炎症标志物。使用MR的无创成像技术可以量化肝脏铁浓度,但由于缺乏使用权或扫描时间过长,可能会受到限制。
最近,DECT被认为是评估肝脏铁的另一种基于无创成像的方式。虽然SECT铁定量使用增加的X射线吸收来间接估计铁,但它容易因脂肪或其他材料的共存而产生误差。DECT材料分解可以是一个更好的选择。使用在双能量模式下扫描的CT检查产生的铁图,可以估计出虚拟铁含量(VIC)。这种方法已被证明与疑似输血性血小板增多症患者的血清铁蛋白水平相关。一些工作表明,基于三物质分解的VIC可以区分临床相关的肝脏铁浓度阈值,其敏感性和特异性与MR R2*弛豫法相似(非常低的铁水平除外)。铁浓度也可以用ΔHU来估计,即低千伏和高千伏数据集之间HU单位的变化。最近,对来自虚拟单能谱图像的低和高能量之间的ΔHU进行了评估,与MR R2*弛豫测量技术相比,显示出强烈的线性相关性。
目前,DECT需要大量的队列验证才能成为一种被广泛接受的铁定量的非侵入性成像技术。因此,MR驱动的技术仍然是基于成像的铁定量的主要方法。通过额外的工作,可以从DECT检查中常规提取肝脏铁含量,而不会给患者带来额外的费用或扫描时间。
更多内容参见:。
门静脉血栓的定性
区分良性和恶性门静脉血栓(PVT)是一项不可或缺的放射学任务。40%的肝癌患者会出现PVT,而以肿瘤侵入门静脉系统为特征的恶性PVT则在高达44%的肝癌患者中发现。恶性PVT对这些患者的预后、肿瘤分期和整体治疗机会有巨大的影响。虽然组织病理学被认为是金标准,但许多成像技术,包括MR、增强超声、多普勒超声和CT已被用于描述和诊断恶性PVT。
使用多期增强CT,在门静脉期图像上很容易识别PVT的存在。然而,动脉晚期的血栓强化是提示恶性PVT的最具体标志。增强评估固有的技术局限性,如兴趣区放置的困难,会限制恶性PVT的充分识别,不能最佳地描述患者的疾病负担,并使治疗效果出现偏差。使用材料特异性碘图的碘定量已被证明可以提高区分恶性肿瘤血栓和普通血栓的总体诊断准确性、敏感性、特异性、阳性预测值和阴性预测值。
脾脏
脾脏定量DECT的范围有限;然而,最近的文献中出现了一些探索应用。有人建议在门静脉期进行基于碘的物质分解以估计脾脏的碘含量,以预测肝硬化引起的门静脉高压病例中食管静脉曲张的严重程度。这项工作表明,定量DECT可能对评估脾脏血流动力学有意义。碘浓度也可能更好地区分副脾和淋巴结,而不是使用CT值测量。
下期我们继续分享盆腔双能量定量的应用。
了解更多双能量内容,关注XI区。
编译整理自:Toia GV, Mileto A, Wang CL, Sahani DV. Quantitative dual-energy CT techniques in the abdomen. Abdom Radiol (NY). 2021 Sep 1. doi: 10.1007/s00261-021-03266-7. 文中均为原作者观点,仅供专业人士交流目的,不用于商业用途。
2021年11月1日
原标题:《腹部双能量CT定量技术(上)》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




