- +1
【学术前沿】JMCB | 彭金荣课题组提出一个依赖S期rDNA复制-转录平衡调控的新的细胞周期检验点
以下文章来源于JMCB科学前沿 ,作者彭金荣课题组
JMCB科学前沿.
分享生命发现,走近科学前沿。学术期刊 Journal of Molecular Cell Biology (JMCB) 将助力更多优秀的科研成果在世界科学舞台精彩亮相!

关注我们,获取更多相关资讯
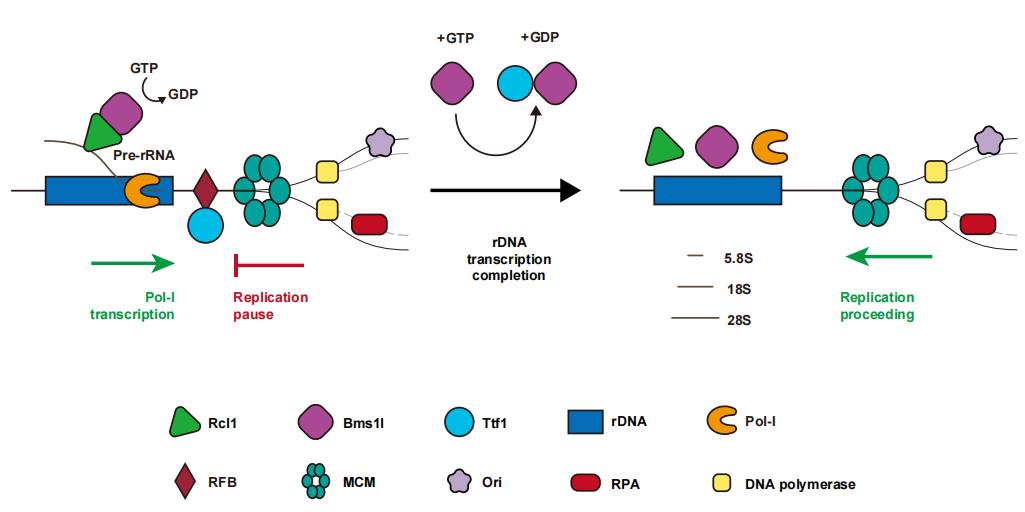
细胞周期的进程受到G1/S, S/G2, G2/M,以及分裂中期/后期检验点的精确调控。近日,Journal of Molecular Cell Biology (JMCB) 在线发表了题为“Nucleolar GTPase Bms1 displaces Ttf1 from RFB-sites to balance progression of rDNA transcription and replication”研究论文。在该论文中,彭金荣等提出一个依赖S期rDNA复制-转录平衡调控的新的细胞周期检验点的概念,并提出该检验点由核仁蛋白Bms1l(一种GTPase酶)与Rcl1和TTF1在rDNA位点轮替互作执行。
在真核生物中,核糖体DNA(rDNA)以数十甚至上百拷贝串联成簇的形式存在于基因组中。rDNA通过RNA聚合酶I转录形成的核糖体RNA前体(pre-rRNA)是18S、5.8S和28S rRNA的共同前体。pre-rRNA的转录在细胞周期S期依然保持高水平,从而导致rDNA的复制和转录发生同向或者相向的冲突。相向冲突可以通过rDNA末尾的复制叉阻抑点(Replication Fork Barrier,RFB)以及结合蛋白Ttf1得到解决。然而关于Ttf1如何从RFB位点解离从而使得复制过程顺利进行至今尚无报导。
本研究中,作者利用斑马鱼遗传模型和人培养细胞模型,报导了核仁中的Bms1通过与Ttf1互作,能够借助Bms1自身的GTPase酶活将Ttf1从RFB位点解离,进而调控细胞周期进程。作者发现在bms1l突变的斑马鱼体内,rDNA转录水平上升、复制叉行进受阻,最终使得细胞周期在S/G2转换过程中受到阻滞,但是整个基因组DNA的复制却保持异常活跃的状态。rDNA转录标志因子ubf、tif-IA和taf1b,DNA损伤反应标志因子Chk2、Rad51和p53,以及复制叉阻滞因子Rpa2、PCNA、Fen1和Ttf1均在bms1l突变体中显著上升,且Ttf1滞留在RFB上,最终导致细胞周期受阻在S期。根据以上研究结果,作者认为核仁蛋白Bms1l通过分别与Rcl1和Ttf1互作,在平衡S期rDNA的转录和复制过程中发挥重要作用,并通过平衡rDNA复制-转录发挥S期检验点的功能。
作者简介
该工作由浙江大学彭金荣团队、黄俊团队以及浙江省台州医院王勇博士合作完成,祝岩清与王勇为论文共同第一作者。
关于JMCB
Journal of Molecular Cell Biology (JMCB) 创刊于2009年10月,由中国科学院主管,由中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)和中国细胞生物学学会共同主办,与牛津大学出版社 (Oxford University Press,OUP) 开展版权合作,为完全开放获取期刊,聚焦分子细胞生物学前沿进展及相关多学科交叉研究,2020年度影响因子为6.216,5年影响因子为6.688,2021年度影响因子将继续稳定上升。
来源:JMCB科学前沿
原标题:《【学术前沿】JMCB | 彭金荣课题组提出一个依赖S期rDNA复制-转录平衡调控的新的细胞周期检验点》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




