- +1
46万美元一针?首款国产CAR-T细胞疗法获美FDA批准
国产创新药出海成功。
当地时间2月28日,传奇生物科技股份有限公司(NASDAQ: LEGN,传奇生物)在美国宣布,其自主研发的细胞治疗产品西达基奥仑赛(英文商品名:CARVYKTI,简称Cilta-cel)获得美国食品和药品监督管理局(FDA)批准上市, 用于治疗复发或难治性多发性骨髓瘤患者,这些患者既往接受过四种或四种以上的治疗,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。
这是传奇生物首款获批上市的产品,是首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批上市的 BCMA 靶向 CAR-T 疗法。今年2月10日,信达生物PD-1肿瘤药闯关FDA遇挫,而此次CAR-T疗法获批,成为中国创新药出海注入了信心。
CAR-T疗法主要是通过基因工程技术,人工改造肿瘤患者的T淋巴细胞,在体外大量培养后生成肿瘤特异性CAR-T细胞,再将其回输入患者体内用以攻击癌细胞,进而达到治疗疾病的目标。与传统的化疗、放疗、靶向等肿瘤治疗方向相比,CAR-T疗法让肿瘤有了治愈的可能,更有说法称其为“神药”。
传奇生物的CARVYKTI是一款具有两种靶向B细胞成熟抗原(BCMA)单域抗体的嵌合抗原受体 (CAR) T细胞免疫疗法,以一次性输液的方式给药,推荐剂量为每公斤体重0.5-1.0×10^6个CAR-T细胞。
此次CARVYKTI的获批主要基于关键性临床1b/2期 CARTITUDE-1研究结果。研究数据显示,Cilta-cel在既往接受过四种或者以上治疗(包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体)的复发或难治性多发性骨髓瘤患者中显示出高达98%的总缓解率。
公开资料显示,全球已经有7款CAR-T疗法获批,其中有两款在中国获批,包括复星凯特的阿基仑赛注射液和药明巨诺的瑞基奥仑赛注射液,均于2021年获批,因此2021年被称为中国CAR-T疗法商业化元年。传奇生物的西达基奥仑赛在国内还处于临床阶段,于2020年8月在中国被纳入“突破性治疗药物”。
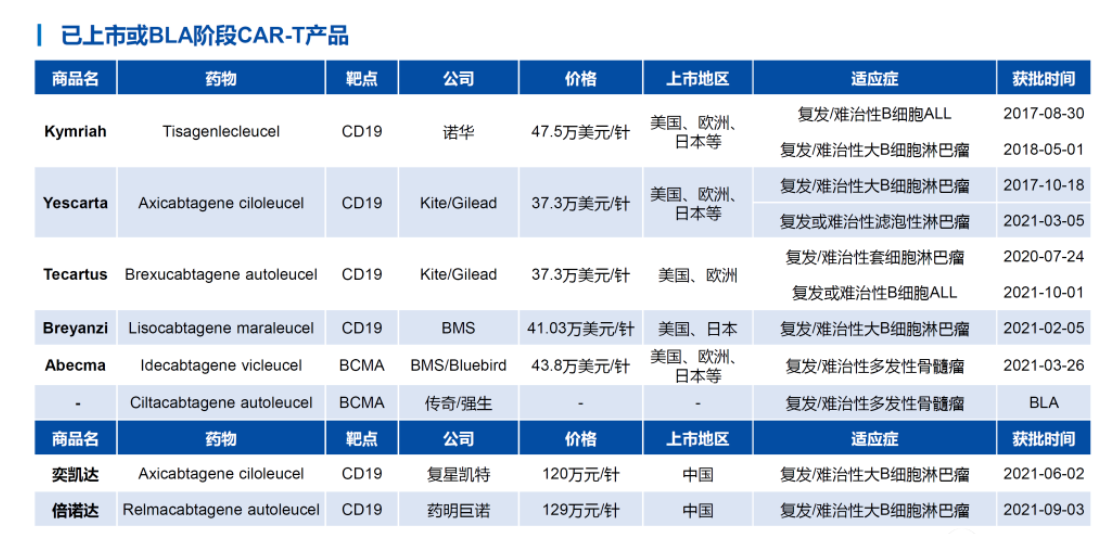
华创证券研报资料
CAR-T疗法价格不菲,两款已经在国内获批的产品价格均达到百万元一针。业内有消息称,传奇生物的西达基奥仑赛价格超过46万美元。对于上述消息,传奇生物向澎湃新闻记者强调,目前价格还不会公布。
如何扩大CAR-T疗法的可及性,此前传奇生物在接受澎湃新闻记者采访时表示,降低CAR-T产品的高昂定价问题可以从两个方向着手,一是国产化替代,二是通用型CAR-T技术发展,减少病患的治疗时间的同时,还可以减轻在患病过程中的痛苦。
传奇生物成立于2014年,是一家集肿瘤免疫细胞疗法研发、临床、生产及商业化开发于一体的跨国生物制药公司。此外,该公司还有多款在硏CAR-T疗法,用于血液瘤、实体瘤及其它疑难疾病的治疗。传奇生物美股盘后大涨超12%。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




