- +1
结直肠癌的筛查、监测及随访
David E. Beck 著
谢忠士 译
傅传刚 校
摘要:结直肠癌根治性手术患者的术后随访,尽管有很多策略,但仍没有共认的最优随访计划。对过于密集监测的有效性学术界仍有激烈讨论。一些数据表明监测提高了肿瘤复发的早期发现和切除率,但并没有改善生存率。理想的或首选的随访计划组成仍很有争议,来自不同专科医师的决策仍有很大的不一致性。
重要的是,患者应该在一定程度上了解术后随访的必要性和局限性,应该积极参与到随访计划的决策中。关于这个问题,一些主要协会的指南很有帮助。
关键词:结直肠癌,筛查,监测,随访,粪便潜血实验,纤维乙状结肠镜,结肠镜,双重对比钡剂灌肠造影,计算机断层扫描结肠镜(仿真结肠镜),粪便 DNA 检测
01
筛查
筛查,最初是用于人口学的方法,被用于疾病的早期发现。病例发现是指在个体基础上的早期发现。这些术语被用于发现结直肠肿瘤发病可能性增加的个体。有效的筛查应符合一些特定的标准,检测应具备有效的科学证据,并可确定一种重要的疾病,而且通常是利大于弊,筛查出的疾病应是可预防或可治疗的,结直肠癌的筛查符合这些标准。
02
结直肠癌
2018 年,美国新增结肠癌和直肠癌病例140250例,其中直肠癌40500例(29%)[1]。死亡50630例(包括结肠癌和直肠癌),死亡率36%[1]。结直肠癌的生存率与诊断时的临床分期和病理分期密切相关。德国多中心研究数据显示Ⅰ、Ⅱ、Ⅲ和Ⅳ期结直肠癌患者的5年生存率分别为 76%、65%、42% 和 16%(不包括手术死亡率)[2]。最近美国国家癌症研究所对1975—2013年的 SEER 数据库癌症统计回顾表明,局部肿瘤的5年生存率是90.1%,区域性转移肿瘤是71.2%,远处转移性肿瘤是13.5%[3]。
目前可以明确的是:如果可以早期发现肿瘤,一方面总体生存率可以得到改善,另一方面甚至可以预防一些结直肠癌的发生。大多数大肠癌直到晚期才出现症状,出现局部梗阻,引起腹痛或排便习惯改变等症状。结肠癌和直肠癌也会伴发出血,可以通过检查粪便中的隐血早期诊断。通过大量观察和研究,包括目前对结直肠癌分子遗传学的了解,结直肠癌的自然病程始于一个腺窝,基因的多发突变缓慢导致小息肉的产生,然后发展成为浸润性癌,癌肿最终出现转移。美国国家息肉研究(NPS)指出在大多数患者,从“干净”的结肠发展出浸润性癌大约需要10年的时间 [4]。这种漫长的、渐进的自然病程为发现早期癌和切除恶性息肉提供了机会(图20-1)。因此,筛查可以直接针对早期癌检测,降低发病率和死亡率;切除癌前病变息肉,降低结直肠癌的发生率。
 ▲ 图 20-1
▲ 图 20-1结直肠癌的自然病程
多种筛查方法可对早期结直肠癌精确检测 [5, 6, 7, 8, 9],不同证据等级的对照试验和病例对照研究表明切除腺瘤性息肉可以降低结直肠癌的发病率,肿瘤的早期检测可以降低结直肠癌的病死率,这更进一步地证明筛查利大于弊。结直肠癌的筛查检测与其他被广泛接受的筛查检测的成本收益比相当 [10, 11]。需要注意的是一旦筛查结果呈阳性,必须对整个结直肠进行全面的检查排除结直肠息肉或肿瘤。筛查应同时努力优化患者和卫生保健提供者的参与情况,提醒患者和医生需要按推荐的时间间隔重新筛查 [12]。
根据美国疾病控制与预防中心(CDC)的数据,仅有2/3符合条件的患者接受了结直肠癌筛查 [13]。最常见的障碍是:被调查者对检查的必要性缺乏认识,医生对检查的建议不足。在没有接受结直肠癌检测或近期没有接受检测的人群中,只有5%的人表示有医生建议进行结直肠癌检测。
大约75%的新发结直肠癌发生在没有已知致病因素的人群中。从40岁左右开始,发病率随年龄增加 [14]。通常认为没有诱发因素的人群处于结直肠癌的平均风险等级。有结直肠癌家族史(如父母、兄弟姐妹或子女中的一个或多个患病),但没有明确的遗传综合征的人群占高危人群的大多数(15%~29%)。遗传性非息肉病性结肠癌(HNPCC)占所有病例的4%~7%,家族性腺瘤性息肉病(FAP)约占1%,其余约 1%。因为其他原因如慢性溃疡性结肠炎、克罗恩病、Peutz-Jeghers 综合征和家族性青少年息肉病等, 罹患结直肠癌的风险升高,但没有 HNPCC 和FAP 高(图 20-2)[10]。其他需要注意的风险因素包括年龄增长、饮食中饱和脂肪含量高而纤维含量低、过量饮酒以及久坐不动的生活方式 [15]。
 ▲ 图 20-2
▲ 图 20-2男女每年大肠癌的新发病例:50 岁无特殊危险因素组;FAP. 家族性腺瘤性息肉病;FH. 家族史;HNPCC. 遗传性非息肉性结肠癌;IBD. 炎症性肠病
没有直接证据表明何时应该停止筛查,但间接证据支持接近生命终点的人群应停止筛查。大多数息肉至少需要10年的时间才能发展成为癌症,如果患者预期寿命不长,那么通过筛查发现息肉可能不符合患者的最佳利益。此外,一般情况下,老年人对筛查和诊断检测的耐受性较差。因此,对大多数人来说,如果筛查和诊断结果不能延长寿命筛查即可终止。停止筛查的年龄还取决于患者和临床医生的判断,要考虑到筛查及其获益之间的时间和患者的预期寿命 [10]。
对结直肠癌平均风险等级人群的筛查不同于高危人群的筛查。临床医生应早在筛查开始前确定个体患者的风险状况。个人的风险状况决定了什么时候应开始筛查、做什么检查以及检查的频率 [12] 。
风险分层可以通过以下几个关于结直肠癌风险因素的问题来实现。
患者既往是否有结直肠癌或腺瘤性息肉病史?
患者是否患有容易诱发结直肠癌的疾病(如炎症性肠病)?
家族成员中是否有人患结直肠癌或腺瘤性息肉?如果有,几个人?是一级亲属(父母、兄弟姐妹或子女)吗?癌症或息肉最初的诊断年龄?
这些问题中任何一个阳性结果都应促使进一步努力查明和确定与风险增加有关的具体情况。
具有平均风险等级的男性和女性,50岁开始应选择下列其中一种进行筛查。一项针对40—49 岁人群的结肠镜筛查研究证实,结直肠癌在这一年龄组中并不常见,这支持了对平均风险等级人群在50岁开始筛查的建议 [16]。
筛查方式有多种选择,没有哪种单一的方法具有明确的优越性,允许患者根据个人偏好进行选择,可增加人群进行筛查的可能性。但不同的方法在有效性、有效性量级、风险或前期成本方面是不同的。医生可通过以下信息向患者介绍每个方法的相对有效性。这些检测是由美国胃肠病学协会 [12]、美国癌症协会 [17] 和美国结肠和直肠外科医师协会指南所推荐。
03
结直肠癌筛查检测
有许多可用的检测,每种检测都有优点和局限性 [12]。
一
粪便试验
1. 粪便潜血试验
本实验提供每年一次的粪便潜血试验(FOBT)筛查,使用的是基于饮食限制的愈创木脂法检测(在检测前3d避免摄入红肉)。从3份连续的粪便中取2份样本进行检测,不进行再水化。标本检测阳性的患者进行结肠镜检查 [12]。美国胃肠病学会建议每年检测 1 次,这样比每2年检测1次更为有效,不建议再水化。较新的基于愈创木脂法的检测方法可以提高灵敏度并保持可接受的特异性。检测期间的饮食限制用于降低更敏感的愈创木脂法检测的假阳性率,但对于不太敏感的愈创木脂法检测则没有必要。
明尼苏达随访18年结果显示,每隔1年进行1次 FOBT 筛查可使结直肠癌死亡率降低21%, 这与两项每2年筛查1次的欧洲实验的结果一致 [7]。筛查组中结直肠癌的发病率也降低 [19]。对3项临床试验的系统回顾表明 [5, 6, 7, 19], 限制饮食并不会减低对高龄、灵敏度较低的愈创木脂法检测的阳性率,而且严格的饮食限制可能会导致依从性的降低 [20]。
FOBT 的缺点是目前的检测会遗漏许多息肉和一些肿瘤。此外,大多数检测阳性的人并没有结直肠肿瘤(检测结果为假阳性),他们将经历结肠镜检查的不适、花费以及风险但无获益。结肠镜检查被推荐用于所有 FOBT 检测阳性的患者,是一种贯穿于大多数临床试验的诊断方法, 并且在检测微小癌和腺瘤方面比双重对比钡灌肠检查(DCBE)更准确 [21]。
2. 粪便免疫组化检测
粪便免疫组化检测(FITs)在探查结直肠癌和腺瘤方面比 FOBT 更敏感。许多 FITs 只需要一个或两个粪便样本,并不需要饮食或药物的限制,增加了其易用性。2008年,美国几个专业协会均支持使用 FITs 来取代 FOBT,因为前者的效率更高,可被更多人接受 [22]。欧洲和亚洲国家也广泛采用 FITs 筛查结直肠癌 [23]。然而, 检测结果的准确性难以确定,据报道结直肠癌的灵敏度 25%~100%,特异度通常超过90%[24]。19项研究的系统回顾和 Meta 分析发现,灵敏度为79%,特异度为95%,总体准确性为96%[25], 增加样本数量并不影响检测结果。
二
粪便 DNA 检测
粪便 DNA 检测基于这样一种观点:由于癌症是一种突变疾病,随着组织从正常到腺瘤再到癌的演变,粪便中应该可以检测到这些突变 [26]。初步报道显示,晚期癌症患者的粪便中可检测到 DNA 突变 [27],这为一项大型研究提供了基础。该研究使用了一个有21个突变的组合,对4000多名接受结肠镜检查、粪便 DNA 检测和采用隐血检测试纸Ⅱ的 FOBT 的无症状患者进行研究 [28]。包括 APC、K-ras、和 p53 突变在内的DNA 标记显示,结直肠癌的灵敏度为 52%,特异度为 94%[29]。这种基于粪便的检测的优点是无创、不需要特殊的结肠准备,并且可监测整个结肠的肿瘤 [30]。由于结直肠癌的 DNA 改变是多样化的,因此需要检测许多基因的突变。
FDA 已经批准了一种商业上可用的检测方法(Cologuard,Exact Scineces,Madision,WI)。这是一个多目标分子组成的粪便 DNA 测试,针对异常甲基化 BMP3、NDRG4 启动子区域、K-ras 基因突变和 β-actin(参考人类 DNA 的基因数量),以及人类的血红蛋白免疫组化测定。每个标记的定量测定被合并到一个经过验证的、预先指定的、逻辑回归算法中,测定值超过183为阳性 [29]。一项对12000多名患者进行的 90 个位点的研究发现,DNA 测定对结直肠癌(92.3%)和晚期癌前病变(42.4%)的检测灵敏度比 FIT 高出近20%[29]。这项测试的未来还将取决于一些因素,如可供选择检测的性能特征、测试间隔、并发症、成本、患者接受度和依从性等 [30, 31, 32]。
三
乙状结肠软镜
建议每5年进行一次乙状结肠镜检查。病例对照研究显示乙状结肠镜检查可降低结直肠癌死亡率 [33, 34, 35],但乙状结肠镜探查不到的区域结肠癌风险并没有降低。5年间隔检查是保守的选择,观察显示10年间隔乙状结肠镜筛查仍可使结直肠癌死亡率降低 [33],结肠镜检查阴性者5年后再次结肠镜检查很少发现进展期肿瘤 [36], 息肉切除后随访结果也表明,结肠镜检查阴性后5年,发展为进展期肿瘤罕见 [37]。由于乙状结肠软镜检查不如结肠镜敏感,检查间隔时间比结肠镜要短。
几项研究表明,远侧结肠没有腺瘤的患者, 近端结肠有进展期腺瘤的比率在2%~5%之间 [38, 39, 40, 41]。如果乙状结肠软镜发现息肉后追加结肠镜检查,可以发现70%~80%近侧结肠的进展期肿瘤 [39]。在一项随机对照实验中,发现息肉时,乙状结肠镜和结肠镜筛查可使结直肠癌发病率降低80%[42]。
在一项非随机对照实验中,每年一次的FOBT 联合5年一次的纤维乙状结肠镜检查与单纯乙状结肠镜检查相比,结直肠癌死亡率降低了43%(无统计学意义)[6]。FOBT/ 乙状结肠镜检测策略的缺点是人们承受了2种检查的不便、成本和并发症,但其有效性不确定。
四
结肠镜检查
结肠镜检查每10年进行1次。虽然还没有研究评估结肠镜筛查是否能降低处于平均风险等级人群中结直肠癌的发病率或死亡率,但有几条证据支持结肠镜筛查的有效性 [12]。有直接证据表明乙状结肠镜筛查降低了结直肠癌的死亡率, 结肠镜检查允许进行更多的大肠检查。结肠镜检查在2项腺瘤性息肉患者的队列研究中显示可降低结肠直肠癌的发病率 [37, 43]。结肠镜检查可以发现和清除息肉,并可以对结肠内的癌进行活检。然而,结肠镜检查比其他的检查更昂贵、更危险、也更不方便,而且并不是所有的检查都能看到整个结肠。因此,结肠镜检查相对于乙状结肠镜检查的附加价值涉及到获益和伤害的权衡 [12]。
对于平均风险等级的人群选择10年作为筛查的间隔(如果之前的检查结果为阴性)是基于对结肠镜检查的灵敏度和进展期腺瘤发展速度的估计。从腺瘤性息肉转变为癌的发展估计平均需要至少10年的时间 [36, 44]。
在两项关于结肠镜检查的大型前瞻性研究中,约有50%的近端进展期肿瘤患者没有远端结肠肿瘤 [38, 39]。同样,一项对一组患有脾曲近端癌的平均风险等级人群中的前瞻性研究发现,65%的患者在脾曲远端没有肿瘤 [45]。1项对所有息肉患者进行乙状结肠镜检查和结肠镜随访的随机对照试验表明,与未接受筛查的患者相比,接受筛查患者结肠直肠癌发病率显著降低 [41]。154名无症状、结肠镜筛查阴性的平均风险等级人群5年后进行第二次结肠镜检查时,进展期肿瘤的发病率低于 1%[35],这为建议的10年间隔时间提供了支持。两项结肠镜检查研究表明,平坦型和凹陷型腺瘤分别占腺瘤的22% 和30%[46, 47],为了不漏掉这些病变,有必要进行染色 [46]。然而, 扁平腺瘤的确切发病率和临床意义尚不清楚。
到2000年底,美国医疗保险系统已经决定报销结肠镜检查费用。结肠镜检查作为最佳的筛查检测开始被一些胃肠病学组织所讨论和提倡 [26]。
五
结肠气钡双重造影
这项检查建议每5年进行1次。双重对比钡灌肠检 查(Double-Contrast Barium Enema,DCBE)对大型息肉和癌的灵敏度大大低于结肠镜检查,该检查不能切除息肉或对癌进行活检, 而且 DCBE 比结肠镜检查更有可能将伪影和其他发现(如粪便)认定为息肉。钡灌肠异常的患者需要结肠镜检查。
包括 DCBE 的原因是它提供了一种可检查整个结肠的替代方法(尽管不那么敏感),可以检测到大约一半的大息肉,这些息肉在临床上可能很重要。作为筛查不建议 DCBE 与乙状结肠软镜联合使用。DCBE 对结肠肿瘤的灵敏度低于结肠镜检查,建议间隔5年检查。
在一项前瞻性两组疾病谱相似人群筛查研究中,DCBE 检测到6~10mm 腺瘤性息肉是结肠镜检测到的53%,超过1cm为 48%[31]。在一项 2193 例连续结直肠癌非随机研究中,DCBE 对癌的灵敏度为85%,结肠镜检查的灵敏度为95%[29]。
六
计算机断层肠镜检查(仿真结肠镜检查)
计算机断层结肠镜检查(CTC)目前不是结直肠癌大规模筛查方法,仅作为结肠镜无法做到盲肠或不适合结肠镜检查患者的备选检查。随着技术、工艺和临床研究的快速进展。CTC 成为大肠癌筛查的另一种选择只是时间问题。
04
结直肠癌高危人群的筛查
筛查高危人群可以采取多种形式。如果息肉和癌在早期出现,患者可以在早期开始筛查,如果从小息肉到恶性肿瘤的进展更快,则可以更频繁地筛查,如果肿瘤发生在较近端,可以通过能够到达右半结肠的检查进行筛查,或者可以通过更敏感的方法进行筛查,如结肠镜检查或DCBE,而不是 FOBT 或乙状结肠镜检查。已经发现患有腺瘤性息肉的患者患结直肠癌的风险更高,因此应该进行监测而不是筛查 [10]。
一
结直肠癌或腺瘤性息肉的家族史
这是一组由一个或多个一级亲属(父母、兄弟姐妹或子女)在60岁以下被诊断为结直肠癌或腺瘤性息肉的个体组成。有重要的证据表明, 癌症在这些人中出现的年龄比在一般风险等级的人群中要早。实际上,40岁有结直肠癌家族史的人与50岁平均风险等级的人患病风险相当 [48]。结肠镜筛查应在40岁或比其家庭中最早诊断的患者的年龄小10岁时开始,两者以较早者为准,并每5年重复 1 次 [12]。表 20-1和表20-2给出了家族遗传风险人群的结直肠癌筛查建议。另一种原发癌患者罹患结肠癌的终生风险见表20-3。
 ▲ 图 20-1
▲ 图 20-1对有家族或遗传风险的罹患人群的结肠癌筛查建议 [12]
 ▲ 图20-2
▲ 图20-2家庭风险 [12]
 ▲ 图 20-3
▲ 图 20-3第二处恶性肿瘤的相关风险 [49]
二
遗传综合征
FAP 筛查见第19章,HNPCC 筛查见第21章。
三
第二处恶性肿瘤的检测
部分患者第二处恶性肿瘤的发病率比正常人群高。犹他州癌症登记中心35000多例癌症病例数据显示,与其他人种、性别和年龄相同的没有罹患过癌症的人群相比,患有一种癌症的男性有1.2倍的可能性患另一处癌症,女性有1.5倍的可能性。原发结肠癌和直肠癌的男性在结肠、直肠、前列腺或膀胱发生第二个癌症的几率更高 [49]。这部分患者应每5年进行1次完整的结肠检查,包括结肠镜检查或纤维乙状结肠镜检查及钡灌肠检查,以检查异位性病变。目前,糖蛋白前列腺特异性抗原(PSA)是诊断和治疗前列腺癌最有效的标志物。尽管 PSA 是前列腺特异,但还不足以单独用于前列腺癌的筛查。PSA 也可由正常的前列腺组织产生,提示前列腺增生。PSA 检测和直肠指诊的结合为前列腺癌的早期诊断提供了可靠的依据,应该每年进行一次 [50]。对于55岁的就诊男性,谨慎的做法是获得血清 PSA 浓度并进行直肠指诊。如果两者都正常,每年进行一次评估。如果直肠指检正常, 但血清 PSA 水平轻度升高(范围4.1~10.0mg/L),应行经直肠超声检查 [51]。如有必要,应每年对尿液行脱落细胞学检查。
女性第二处癌症更可能发生在结肠、直肠、子宫颈、子宫或卵巢 [51]。因此,应该每5年进行1次完整的大肠检查,乳房 X 线片检查、盆腔检查和巴氏涂片检查应作为年度常规检查的一部分进行。
05
检测
监测是对已知有结肠或直肠疾患者群的监测。
一
切除腺瘤性息肉后
监测的主要方法是结肠镜检查和 DCBE,监测有效性的最佳证据来自结肠镜检查。在国家息肉研究(NPS)中,1418名患者定期接受结肠镜检查,结肠或直肠摘除一个或多个腺瘤性息肉,平均随访时间为5.9年,在对年龄、性别和息肉大小进行调整后,与3组未进行监测的参考组(来自于已发表的报道)相比,癌症的发病率比预期低76%~90%。该研究使用参考组作为对照,假设接受息肉切除的患者与未接受息肉切除的参考人群的癌症发病率相同(图 20-3)。
 ▲ 图 20-3
▲ 图 20-3国家息肉研究队列结肠镜检查后观察到的和预期的结肠直肠癌发病率
NPS 还研究了监视的可选频率,所有息肉切除患者被随机分配到息肉切除后1年和3年后,或仅仅3年后进行结肠镜检查。两组在病理为进展期的腺瘤性息肉检出率上无差异(均为3%)[52],表明息肉切除后的首次随访筛选可至少推迟3年。该研究还表明,如果第一次结肠镜检查的结果是阴性,随后检查很可能不会发现更多的腺瘤性息肉。
当前息肉随访的建议由美国结直肠癌多社会工作组和美国癌症协会联合推荐,建议高风险患者(定义为3个或3个以上的腺瘤、高度不典型增生、有绒毛特性、大小超过 1cm 腺瘤)3年后随访结肠镜检查。风险较低的患者(1或2个小于1cm 的管状腺瘤,没有高度不典型增生)可以在5~10年内随访评估。只有增生性息肉的患者与一般风险人群一样的10年随访评估。最近有研究报道结肠镜检查遗漏了大量的癌症 [53], 前述建议前提是假设高质量结肠镜检查,包括良好肠道准备和充足的退镜时间,不充分的肠道准备需要改变随访建议。
在息肉切除后使用钡灌肠进行监测的研究尚未见报道,比较钡灌肠与结肠镜检查的研究也未见报道 [10]。
新的证据支持结肠镜下息肉切除可减少后续结直肠癌发病率的观点 [12]。一项息肉切除后监测的研究显示,大肠癌的发病率降低了 66%,与之前报道的 NPS 结果相似 [43]。
没有直接证据表明何时停止监测。与筛查一样,应停止监测的年龄取决于患者及医生的判断,同时考虑患者的病史和伴随疾病。切除息肉的特征和随访检查的结果也应加以考虑。
二
炎症性肠病患者
炎症性肠病患者进行结直肠癌监测的主要目的是检测中度至重度不典型增生和早期癌,而不是息肉。应对有8年左右病史的患者进行监测,8年后开始出现癌变风险。监测能否预防直肠结肠切除尚有争议(详见第23章)。
三
输尿管乙状结肠吻合术
大部分输尿管乙状结肠吻合术已被回肠膀胱成形术或回肠代膀胱取代,已很少有患者有这种情况。最近研究发现,输尿管膀胱成形术或回肠代膀胱患者与输尿管乙状结肠吻合术患者具有同样高的患癌风险。回肠膀胱成形术或回肠代膀胱的患者平均需要18年(范围5~29年)发展成为恶性肿瘤,大部分癌或腺瘤位于吻合口。在实验大鼠模型中,曾一度认为尿流中需要有粪便物质才能发展成肿瘤。后来的研究对这一概念提出了质疑,最近在回肠造瘘或回肠代膀胱中发现的恶性肿瘤也证实了尿液本身可以引起恶性肿瘤。发病机制尚不清楚,但在大鼠研究和人类研究中发现,革兰阴性菌产生的亚硝胺可能是致癌机制的一部分 [27]。输尿管乙状结肠吻合术患者应行纤维乙状结肠镜或结肠镜检查。检查应在原手术10年后开始,并应每年重复一次 [54]。如果在吻合口发现息肉,内镜下切除是不可取的,因为它们大多位于输尿管乙状结肠吻合口的部位 [55, 56]。如果可能的话,患者应该选择另一种转流尿液的方法 [56, 57]。
四
根治性切除后
结直肠癌患者术前应行结肠镜检查排除同时复发肿瘤。如果术前有结肠梗阻,结肠镜检查应该在手术后大约6个月进行。如果术前检查正常,应在3年后进行结肠镜检查,如果正常,则每5年进行一次结肠镜检查 [12]。随访的目的是检测局部复发、远处转移、异位性癌和腺瘤以及其他原发癌。
结肠直肠癌术后随访的基本原理是基于这样一种假设,即在无症状患者中检测到早期复发癌,相比于症状更严重的进展期复发肿瘤,早期复发癌可以更有效的治疗。
一般而言,调查内容包括病史及体格检查、内镜检查、癌胚抗原(CEA)、肝功能检查、超声波及 / 或计算机断层扫描(CT),以及胸部 X线片。
大约30%~50%的结肠癌和直肠癌患者根治性切除后会复发 [58]。在 Sugarbaker 等的系列研究中 [59],85% 的复发患者在2.5年内复发,所有复发部位的复发时间大致相同,中位数为17个月。Pihl 等的系列研究显示 [60],50%的肝转移在治疗21~22个月内出现明显的临床症状, 而肺转移则在22~34个月内出现明显的临床症状。在所有复发病例中, 腹腔内复发占84%;15%的复发仅涉及远处转移 [59],约35%的患者有肝转移,其中约20%的转移仅发生在肝脏。
10%~22%的患者有肺转移,其中约10%的患者为孤立的肺转移 [58]。
06
复发和转移
仔细的病史记录和体格检查是有效的监测手段。几项前瞻性研究表明,21%~48%的晚期癌症患者的症状和体征首先提示复发 [61, 62]。Beart 等进行了一项的研究 [63],168名结肠直肠切除患者至少每15周随访一次,随访时间长达 4 年, 在48例复发患者中,41例体格检查、生化和放射学检查阳性结果之前就出现了症状,包括咳嗽、腹痛和盆腔痛、排便习惯改变、直肠出血和不适。体格检查是发现复发的重要手段,但不如症状敏感。所有体格检查阳性患者均已出现症状或 CEA 阳性。因为有症状或体格检查发现的复发性癌,大多已是晚期不可治愈 [61]。
碱性磷酸酶是最敏感的肝功能检测方法 [63], 但它也有很高的假阳性率,因此,如果单独使用,几乎没有预测价值 [61]。
胸部 X 线片片无创且价格便宜,大多数临床医生每年采用。任何有可疑或阳性病变的患者都应接受胸部 CT 扫描。因为结果有些不可靠, 腹部 CT 扫描不是常规检查。由于手术对盆腔结构的影响可持续长达 2 年,CT 发现早期复发更加困难,然而,CT 扫描在评估有症状的患者和确认复发方面非常重要 [58]。CT 扫描检测肝转移更为准确,灵敏度为85%~90%;与超声和磁共振成像(MRI)相似。当 CT 扫描存疑的时候, 正电子发射断层扫描(PET)可以帮助诊断 [64, 65]。
Meta 分析表明,每3~12个月CT 检查可使生存获益 [66]。然而,也有人报道 CT 扫描并没有增加根治性肝切除术的数量 [67]。在发现可治愈盆腔或局部复发方面结果也令人失望 [68, 69, 70]。当使用辅助放疗时,放疗后改变进一步图像的解释复杂化 [71]。
CEA 是鉴定复发或转移的敏感标志物。CEA 水平升高最常见于肝转移患者;95%的肝转移患者血浆 CEA 水平升高。但另一方面,腹部或盆腔局部复发患者中,17%~25%的患者CEA 水平正常。在70例复发患者中,89%的患者通过其他方法检测到复发前血浆 CEA 水平的升高。然而,CEA 并不总是在可切除的阶段发现复发或转移。Beart 等报道 [63],48例 CEA 升高患者中,只有1例有可切除的病变。但在另一组146名 CEA 升高的无症状患者中,95%的患者有复发迹象,其中58%的患者可以切除以获得治愈 [72]。Moertel 等开展一项全国范围大型非对照研究中 [73],第一年每12周进行一次评估, 第二年每4个月进行1次评估,之后每6个月进行1次评估,并辅以血红蛋白和血液的化学分析以及胸部放射线片。在第24和第48周以及之后的每年,接受直肠镜检查或结肠造影检查或结肠镜检查。根据医师的惯例,CEA 检测是可选项。在1216例结肠癌手术患者中,1017例(84%)
接受 CEA 监测。在417例复发患者中,59%的患者 CEA 浓度升高。在600例无复发的患者中,16%的患者出现假阳性结果。CEA 检测对肝或腹膜后转移最为敏感,对局部、肺或腹膜转移相对不敏感。115 例CEA 升高的患者进行手术探查,47例复发,通常为肝脏,进行根治性切除。38名 CEA 浓度正常患者和23名未被监测的患者也进行了手术切除,通常是由于肺部或局部复发。追加手术后,2.3% 的 CEA 监测患者在术后一年仍无病生存(CEA 升高患者占2.9%,无升高患者占1.9%),没有监测 CEA 患者为2%。作者的结论,由于监测 CEA 使癌症治愈很罕见。因此,这么小的收益是否能抵得上这么大的经济成本,以及这种干预给患者带来的生理和心理上的压力值得怀疑。尽管包括 CEA 评估在内的术后强化随访的确能更早发现复发,从而提高可切除率,但它们并不能转化为更高的生存率。瑞典的Ohlsson 等进行了一项前瞻性随机研究 [68],调查107名随访时间从5.5~8.8年的患者术后强化随访与无随访的价值。这项研究显示在存活率上没有差异。丹麦的 Kjeldsen 等进行了一项类似但规模更大的前瞻性随机研究 [63]。597名患者的总体生存率和疾病相关生存率也没有改善。Richard 和 McLeod 通过 Medline 检索1966—1996年2月发表的文章,对结肠直肠癌患者术后随访的文献进行了批判性的审查 [58],该报道包括随机对照临床试验、队列研究和描述性研究。从综述结果来看,作者认为无论是支持还是反驳随访监测项目检测复发性大肠癌的价值,都没有确凿的证据。作者指出大多数研究存在许多缺陷,包括样本量小、患者偏倚和随访方案差异。作者估计, 即使术后监测有效,生存获益也不会大于 10%。另一方面,在对7项非随机研究3283 名患者的Meta 分析中,Bruinvels 等发现 [79],密集随访患者总体生存率提高了9%,其中包括更多的无症状复发和更多的复发手术。
外科医生和患者应该了解术后密切随访发现复发和转移的局限性,应讨论制定个体化随访方案,以适应每个患者的需要。
一
异时性癌和息肉
结直肠癌切除术后监测的目的是清除术前未清除的腺瘤,并检测异时性癌。在3~20年内, 异时性大肠癌的发病率约为2%~4%[75, 76, 77]。每3~5年定期采用结肠镜检查大肠可提供最准确的结果。另一种选择是使用纤维乙状结肠镜结合 DCBE,也可能在不久的将来使用 CT 结肠造影术。
在这种情况下,尚没有关于监测策略有效性的对照研究。现有资料表明,异时性癌的生物学行为与原发癌并无不同,只是发生的频率有所增加。
二
其他原发恶性肿瘤
在患者获得长期生存之前,其他原发癌的检测并不重要。这个事实通常被忽视,未被意识到,或被遗忘。Enblad 等 [49] 在1960—1981年向瑞典癌症登记中心报道,他们分析了38166例结肠癌和23603例直肠癌患者的第二原发恶性疾病的发生情况。第二原发恶性疾病的总相对危险度(RR)在结肠癌(女性,RR =1.4;男性,RR =1.3)和直肠癌(女性,RR =1.4;男性, RR = 1.3)后显著增加。第二原发疾病的风险增加发生在胃、小肠、卵巢、子宫内膜、子宫颈、乳房、肾脏、膀胱和前列腺(表 20-3)。
07
结论
对于结直肠癌的最佳随访方案还没有形成普遍的共识。一些数据表明,监测可提高复发的早期发现和切除的几率,但这并不一定总能转化成生存率的提高。重要的是患者要了解术后随访的局限性,并积极参与随访计划的决策。来自主要协会的指南在讨论中会很有帮助(见表20-4)[78, 79, 80]。
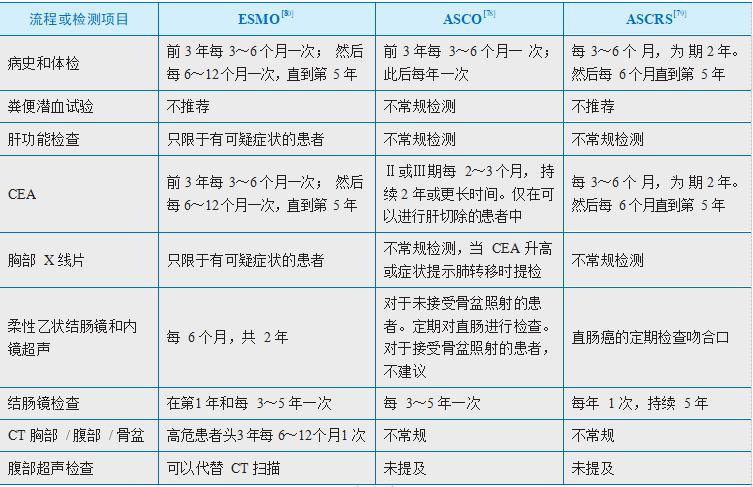 ▲ 表 20-4
▲ 表 20-4ASCO. 美国临床肿瘤学会;ASCRS. 美国结直肠外科医生学会;CEA. 癌胚抗原;CT. 计算机断层扫描;ESMO. 欧洲肿瘤学会
参考文献
[1]https://seer.cancer.gov/statfacts/html/colorect.html. Accessed June 19, 2018
[2]Hermanek P, Sobin LH. Colorectal carcinoma. In: Hermanek P, Gaspodarowicz MK, Henson DE, Hutter RVP, Sobin LH, eds. Prognostic Factors in Cancer. HCII. International Union against Cancer. Berlin: Springer-Verlag; 1995:64–79. Available at: http://seer.cancer.gov/csr/1975_2013/browse_csr.php?section-
SEL=6&pageSEL=sect_06_table.12.html. Accessed October 30, 2016
[3]Jessup JM, Menck HR, Fremgen A, Winchester DP. Diagnosing colorectal carci- noma: Clinical and molecular approaches. CA Cancer J Clin. 1997; 47:70–92
[4]Winawer SJ, Zauber AG, Stewart E, O’Brien MJ. The natural history of colorectal cancer. Opportunities for intervention. Cancer. 1991; 67(4) Suppl:1143–1149
[5]Mandel JS, Bond JH, Church TR, et al. Reducing mortality from colorectal can- Cer by screening for fecal occult blood. Minnesota Colon Cancer Control Study. N Engl J Med. 1993; 328(19):1365–1371
[6]Winawer SJ, Flehinger BJ, Schottenfeld D, Miller DG. Screening for colorectal cancer with fecal occult blood testing and sigmoidoscopy. J Natl Cancer Inst. 1993; 85(16):1311–1318
[7]Kronborg O, Fenger C, Olsen J, Jørgensen OD, Søndergaard O. Randomised study of screening for colorectal cancer with faecal-occult-blood test. Lancet. 1996; 348(9040):1467–1471
[8]Hardcastle JD, Chamberlain JO, Robinson MHE, et al. Randomised controlled trial of faecal-occult-blood screening for colorectal cancer. Lancet. 1996; 348 (9040):1472–1477
[9]Kewenter J, Brevinge H, Engarås B, Haglind E, Ahrén C. Results of screening, rescreening, and follow-up in a prospective randomized study for detection of colorectal cancer by fecal occult blood testing. Results for 68,308 subjects.
Scand J Gastroenterol. 1994; 29(5):468–473
[10]Winawer SJ, Fletcher RH, Miller L, et al. Colorectal cancer screening: clinical guidelines and rationale. Gastroenterology. 1997; 112(2):594–642
[11]Bond JH. Screening for colorectal cancer: confuting the refuters. Gastrointest Endosc. 1997; 45(1):105–109
[12]Winawer S, Fletcher R, Rex D, et al. Gastrointestinal Consortium Panel. Color- ectal cancer screening and surveillance: clinical guidelines and rationale-Up- date based on new evidence. Gastroenterology. 2003; 124(2):544–560
[13]http://www.cdc.gov/vitalsigns/CancerScreening/ColorectalCancer/index.html Accessed October 30, 2016
[14]Surveillance, Epidemiology and Results (SEER) Program, 1973–1992. Bethes- da, MD: National Cancer Institute
[15]Potter JD, Slattery ML, Bostick RM, Gapstur SM. Colon cancer: a review of the epidemiology. Epidemiol Rev. 1993; 15(2):499–545
[16]Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Results of screening colonoscopy among persons 40 to 49 years of age. N Engl J Med. 2002; 346(23):1781–1785
[17]Smith RA, Cokkinides V, Eyre HJ. American Cancer Society Guidelines for the Early Detection of Cancer, 2005. CA Cancer J Clin. 2005; 55(1):31–44, quiz 55–56
[18]Mandel JS, Church TR, Ederer F, Bond JH. Colorectal cancer mortality: effec- tiveness of biennial screening for fecal occult blood. J Natl Cancer Inst. 1999; 91(5):434–437
[19]Mandel JS, Church TR, Bond JH, et al. The effect of fecal occult-blood screening on the incidence of colorectal cancer. N Engl J Med. 2000; 343(22):1603–1607
[20]Pignone M, Campbell MK, Carr C, Phillips C. Meta-analysis of dietary restric- tion during fecal occult blood testing. Eff Clin Pract. 2001; 4(4):150–156
[21]Winawer SJ, Stewart ET, Zauber AG, et al. National Polyp Study Work Group. A comparison of colonoscopy and double-contrast barium enema for surveil- lance after polypectomy. N Engl J Med. 2000; 342(24):1766–1772
[22]Whitlock EP, Lin JS, Liles E, Beil TL, Fu R. Screening for colorectal cancer: a tar- geted, updated systematic review for the U.S. Preventive Services Task Force.
Ann Intern Med. 2008; 149(9):638–658
[23]Chen LS, Yen AM, Chiu SY, Liao CS, Chen HH. Baseline faecal occult blood con- centration as a predictor of incident colorectal neoplasia: longitudinal fol- low-up of a Taiwanese population-based colorectal cancer screening cohort.
Lancet Oncol. 2011; 12(6):551–558
[24]Rabeneck L, Rumble RB, Thompson F, et al. Fecal immunochemical tests com- pared with guaiac fecal occult blood tests for population-based colorectal cancer screening. Can J Gastroenterol. 2012; 26(3):131–147
[25]Lee JK, Liles EG, Bent S, Levin TR, Corley DA. Accuracy of fecal immunochemi- cal tests for colorectal cancer: systematic review and meta-analysis. Ann In- tern Med. 2014; 160(3):171–181
[26]Ransohoff DF. Colon cancer screening in 2005: status and challenges. Gastro- enterology. 2005; 128(6):1685–1695
[27]Ahlquist DA, Skoletsky JE, Boynton KA, et al. Colorectal cancer screening by detection of altered human DNA in stool: feasibility of a multitarget assay panel. Gastroenterology. 2000; 119(5):1219–1227
[28]Imperiale TF, Ransohoff DF, Itzkowitz SH, Turnbull BA, Ross ME, Colorectal Cancer Study Group. Fecal DNA versus fecal occult blood for colorectal-can- cer screening in an average-risk population. N Engl J Med. 2004; 351 (26):2704–2714
[29]Rex DK, Rahmani EY, Haseman JH, Lemmel GT, Kaster S, Buckley JS. Relative sensitivity of colonoscopy and barium enema for detection of colorectal can- cer in clinical practice. Gastroenterology. 1997; 112(1):17–23
[30]Walsh JME, Terdiman JP. Colorectal cancer screening: scientific review. JAMA. 2003; 289(10):1288–1296
[31]Zauber AG, Lansdorp-Vogelaar I, Knudsen AB, Wilschut J, van Ballegooijen M, Kuntz KM. Evaluating Test Strategies for Colorectal Cancer Screening — Age to Begin, Age to Stop, and Timing of Screening Intervals: A Decision Analysis of Colorectal Cancer Screening for the U.S. Preventive Services Task Force from the Cancer Intervention and Surveillance Modeling Network (CISNET). Rockville, MD: Agency for Healthcare Research and Quality; March 2009 (AHRQ publication no. 08–05124-EF-2)
[32]Imperiale TF, Ransohoff DF, Itzkowitz SH, et al. Multitarget stool DNA testing for colorectal-cancer screening. N Engl J Med. 2014; 370(14):1287–1297
[33]Selby JV, Friedman GD, Quesenberry CP, Jr, Weiss NS. A case-control study of screening sigmoidoscopy and mortality from colorectal cancer. N Engl J Med. 1992; 326(10):653–657
[34]Newcomb PA, Norfleet RG, Storer BE, Surawicz TS, Marcus PM. Screening sig- moidoscopy and colorectal cancer mortality. J Natl Cancer Inst. 1992; 84 (20):1572–1575
[35]Müller AD, Sonnenberg A. Protection by endoscopy against death from color- ectal cancer. A case-control study among veterans. Arch Intern Med. 1995; 155(16):1741–1748
[36]Rex DK, Cummings OW, Helper DJ, et al. 5-year incidence of adenomas after negative colonoscopy in asymptomatic average-risk persons [see comment].
Gastroenterology. 1996; 111(5):1178–1181
[37]Winawer SJ, Zauber AG, Ho MN, et al. The National Polyp Study Workgroup. Prevention of colorectal cancer by colonoscopic polypectomy. N Engl J Med. 1993; 329(27):1977–1981
[38]Levin TR, Palitz A, Grossman S, et al. Predicting advanced proximal colonic neoplasia with screening sigmoidoscopy. JAMA. 1999; 281(17):1611–1617
[39]Lieberman DA, Weiss DG, Bond JH, Ahnen DJ, Garewal H, Chejfec G. Use of co- lonoscopy to screen asymptomatic adults for colorectal cancer. Veterans Af- fairs Cooperative Study Group 380. N Engl J Med. 2000; 343(3):162–168
[40]Imperiale TF, Wagner DR, Lin CY, Larkin GN, Rogge JD, Ransohoff DF. Risk of advanced proximal neoplasms in asymptomatic adults according to the distal colorectal findings. N Engl J Med. 2000; 343(3):169–174
[41]Farraye FA, Wallace M. Clinical significance of small polyps found during screening with flexible sigmoidoscopy. Gastrointest Endosc Clin N Am. 2002; 12(1):41–51
[42]Thiis-Evensen E, Hoff GS, Sauar J, Langmark F, Majak BM, Vatn MH. Popula- tion-based surveillance by colonoscopy: effect on the incidence of colorectal cancer. Telemark Polyp Study I. Scand J Gastroenterol. 1999; 34(4):414–420
[43]Citarda F, Tomaselli G, Capocaccia R, Barcherini S, Crespi M, Italian Multi- centre Study Group. Efficacy in standard clinical practice of colonoscopic pol- ypectomy in reducing colorectal cancer incidence. Gut. 2001; 48(6):812–815
[44]Hofstad B, Vatri M. Growth rate of colon polyps and cancer. Gastrointest En- dosc Clin N Am.. 1997; 7:345–363
[45]Rex DK, Chak A, Vasudeva R, et al. Prospective determination of distal colon findings in average-risk patients with proximal colon cancer. Gastrointest En- dosc. 1999; 49(6):727–730
[46]Rembacken BJ, Fujii T, Cairns A, et al. Flat and depressed colonic neoplasms: a prospective study of 1000 colonoscopies in the UK. Lancet. 2000; 355 (9211):1211–1214
[47]Saitoh Y, Waxman I, West AB, et al. Prevalence and distinctive biologic fea- tures of flat colorectal adenomas in a North American population. Gastroen- terology. 2001; 120(7):1657–1665
[48]Fuchs CS, Giovannucci EL, Colditz GA, Hunter DJ, Speizer FE, Willett WC. A prospective study of family history and the risk of colorectal cancer. N Engl J Med. 1994; 331(25):1669–1674
[49]Enblad P, Adami HO, Glimelius B, Krusemo U, Påhlman L. The risk of subse- quent primary malignant diseases after cancers of the colon and rectum. A nationwide cohort study. Cancer. 1990; 65(9):2091–2100
[50]Barry MJ. Clinical practice. Prostate-specific-antigen testing for early diagno- sis of prostate cancer. N Engl J Med. 2001; 344(18):1373–1377
[51]Oesterling JE. Prostate-specific antigen. Improving its ability to diagnose early prostate cancer. JAMA. 1992; 267(16):2236–2238
[52]Winawer SJ, Zauber AG, O’Brien MJ, et al. The National Polyp Study Work- group. Randomized comparison of surveillance intervals after colonoscopic removal of newly diagnosed adenomatous polyps. N Engl J Med. 1993; 328 (13):901–906
[53]Winawer SJ, Zauber AG, Fletcher RH, et al. US Multi-Society Task Force on Col- orectal Cancer, American Cancer Society. Guidelines for colonoscopy surveil- lance after polypectomy: a consensus update by the US Multi-Society Task Force on Colorectal Cancer and the American Cancer Society. Gastroenterol- ogy. 2006; 130(6):1872–1885
[54]Filmer RB, Spencer JR. Malignancies in bladder augmentations and intestinal conduits. J Urol. 1990; 143(4):671–678
[55]Woodhouse CRJ, British Society for Gastroenterology, Association of Colo- proctology for Great Britain and Ireland. Guidelines for monitoring of patients with ureterosigmoidostomy. Gut. 2002; 51 Suppl 5:V15–V16
[56]Hurlstone DP, Wells JM, Bhala N, McAlindon ME. Ureterosigmoid anastomo- sis: risk of colorectal cancer and implications for colonoscopists. Gastrointest Endosc. 2004; 59(2):248–254
[57]Azimuddin K, Khubchandani IT, Stasik JJ, Rosen L, Riether RD. Neoplasia after ureterosigmoidostomy. Dis Colon Rectum. 1999; 42(12):1632–1638
[58]Richard CS, McLeod RS. Follow-up of patients after resection for colorectal cancer: a position paper of the Canadian Society of Surgical Oncology and the Canadian Society of Colon and Rectal Surgeons. Can J Surg. 1997; 40 (2):90–100
[59]Sugarbaker PH, Gianola FJ, Dwyer A, Neuman NR. A simplified plan for fol- low-up of patients with colon and rectal cancer supported by prospective studies of laboratory and radiologic test results. Surgery. 1987; 102(1):79–87
[60]Pihl E, Hughes ESR, McDermott FT, Johnson WR, Katrivessis H. Lung recur- rence after curative surgery for colorectal cancer. Dis Colon Rectum. 1987; 30 (6):417–419
[61]Kelly CJ, Daly JM. Colorectal cancer. Principles of postoperative follow-up.Cancer. 1992; 70(5) Suppl:1397–1408
[62]Goldberg RM, Fleming TR, Tangen CM, et al. Surgery for recurrent colon can- cer: strategies for identifying resectable recurrence and success rates after re- section. Eastern Cooperative Oncology Group, the North Central Cancer Treatment Group, and the Southwest Oncology Group. Ann Intern Med. 1998; 129(1):27–35
[63]Beart RW, Jr, Metzger PP, O’Connell MJ, Schutt AJ. Postoperative screening of patients with carcinoma of the colon. Dis Colon Rectum. 1981; 24 (8):585–588
[64]Zheng G, Johnson RJ, Eddleston B, James RD, Schofield PF. Computed tomo- graphic scanning in rectal carcinoma. J R Soc Med. 1984; 77(11):915–920
[65]Tzimas GN, Koumanis DJ, Meterissian S. Positron emission tomography and colorectal carcinoma: an update. J Am Coll Surg. 2004; 198(4):645–652
[66]Renchan AG, Egger M, Saunders MP, O’Dwyer ST. Impact on survival of inten- sive follow up after curative resection for colorectal cancer: Systematic re- view and meta-analysis of randomized trials. BMJ. 2002; 384:813–818
[67]Schoemaker D, Black R, Giles L, Toouli J. Yearly colonoscopy, liver CT, and chest radiography do not influence 5-year survival of colorectal cancer pa- tients. Gastroenterology. 1998; 114(1):7–14
[68]Ohlsson B, Breland U, Ekberg H, Graffner H, Tranberg KG. Follow-up after cu- rative surgery for colorectal carcinoma. Randomized comparison with no fol- low-up. Dis Colon Rectum. 1995; 38(6):619–626
[69]Kjeldsen BJ, Kronborg O, Fenger C, Jørgensen OD. A prospective randomized study of follow-up after radical surgery for colorectal cancer. Br J Surg. 1997; 84(5):666–669
[70]Pietra N, Sarli L, Costi R, Ouchemi C, Grattarola M, Peracchia A. Role of follow- up in management of local recurrences of colorectal cancer: a prospective, randomized study. Dis Colon Rectum. 1998; 41(9):1127–1133
[71]Pfister DG, Benson AB, III, Somerfield MR. Clinical practice. Surveillance strat- egies after curative treatment of colorectal cancer. N Engl J Med. 2004; 350 (23):2375–2382
[72]Martin EW, Jr, Minton JP, Carey LC. CEA-directed second-look surgery in the asymptomatic patient after primary resection of colorectal carcinoma. Ann Surg. 1985; 202(3):310–317
[73]Moertel CG, Fleming TR, Macdonald JS, Haller DG, Laurie JA, Tangen C. An evaluation of the carcinoembryonic antigen (CEA) test for monitoring pa- tients with resected colon cancer. JAMA. 1993; 270(8):943–947
[74]Bruinvels DJ, Stiggelbout AM, Kievit J, van Houwelingen HC, Habbema JD, van de Velde CJH. Follow-up of patients with colorectal cancer. A meta-analysis. Ann Surg. 1994; 219(2):174–182
[75]Törnqvist A, Ekelund G, Leandoer L. Early diagnosis of metachronous colorec- tal carcinoma. Aust N Z J Surg. 1981; 51(5):442–445
[76]Luchtefeld MA, Ross DS, Zander JD, Folse JR. Late development of metachro- nous colorectal cancer. Dis Colon Rectum. 1987; 30(3):180–184
[77]Heald RJ, Bussey HJR. Clinical experiences at St. Mark’s Hospital with multiple syn- chronous cancers of the colon and rectum. Dis Colon Rectum. 1975; 18(1):6–10
[78]Meyerhardt JA, Mangu PB, Flynn PJ, et al. American Society of Clinical Oncology. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement. J Clin Oncol. 2013; 31(35):4465–4470
[79]Steele SR, Chang GJ, Hendren S, et al. Clinical Practice Guidelines Committee of the American Society of Colon and Rectal Surgeons. Practice Guideline for the surveillance of patients after curative treatment of colon and rectal can- cer. Dis Colon Rectum. 2015; 58(8):713–725
[80]Figueredo A, Rumble RB, Maroun J, et al. Gastrointestinal Cancer Disease Site Group of Cancer Care Ontario’s Program in Evidence-based Care. Follow-up of patients with curatively resected colorectal cancer: a practice guideline. BMC Cancer. 2003; 3:26–38
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




