- +1
百万一针抗癌神药CAR-T销量如何?有药企上半年开出77张处方
半年报收官,三家国内企业不同程度公布了“抗癌神药”CAR-T疗法相关业绩。
8月30日晚间,药明巨诺(02126.HK)公布2022上半年业绩,显示上半年营收6600万元。目前,药明巨诺仅有一款商业化产品,即靶向CD19自体CAR-T细胞免疫治疗产品倍诺达。2021年9月,该产品获批上市,用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤,成为中国首个获批为1类生物制品的CAR-T产品。
半年报显示,上半年,公司开具了77张倍诺达处方,完成64位患者的回输。医院数量方面,公司在中国83家医院完成了培训、试运行及评估,并认证该等医院合资格使用倍诺达。
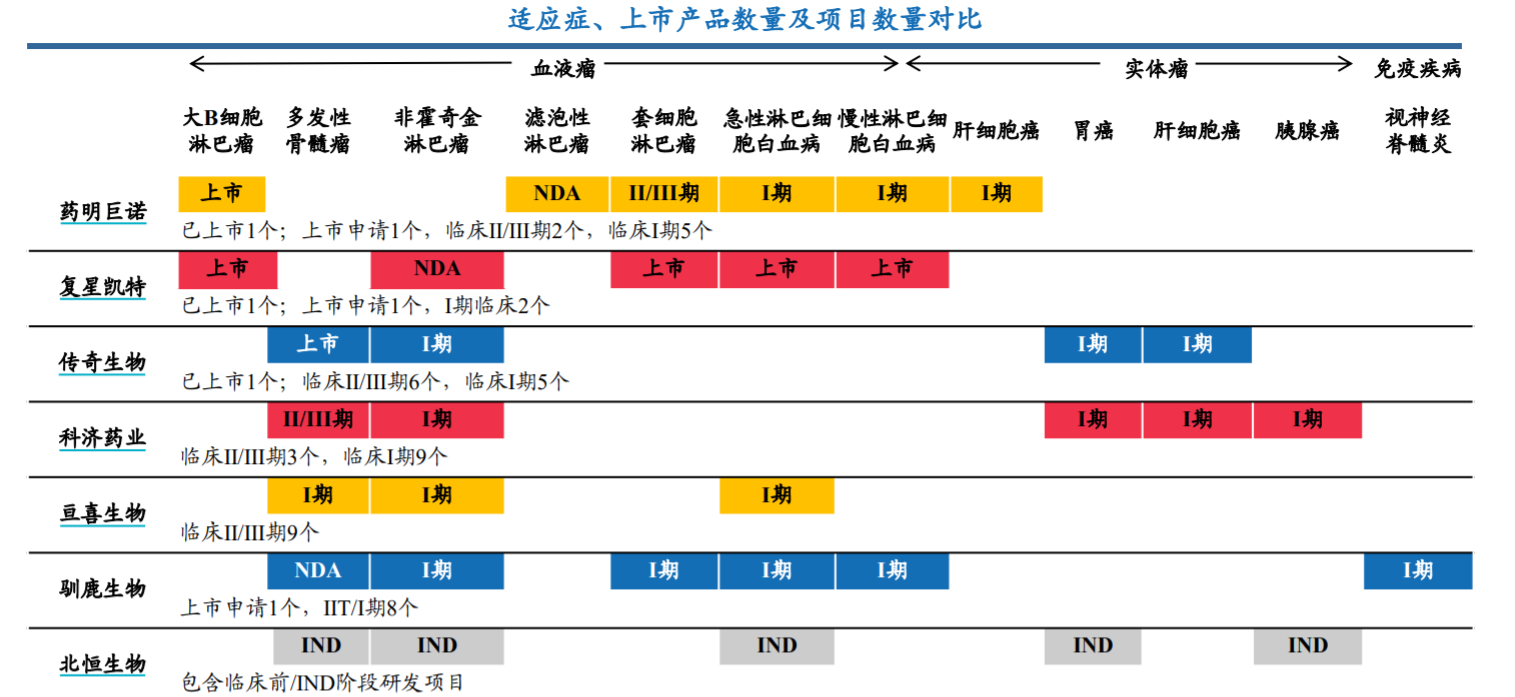
CAR-T疗法各企业适应证、上市产品、项目对比 来源:华安证券研报
在药明巨诺CAR-T产品获批之前,2021年6月,复星凯特的阿基仑赛注射液(商品名:奕凯达)也获批,是国内首个获批上市的CAR-T细胞治疗产品。复星凯特是复星医药的合营公司,复星医药半年报并未披露这款产品具体使用的患者人数,不过提到,截至2022年7月末,备案的治疗中心达近百家。一季报则显示,截至今年2月末,已有约百名患者进入治疗流程,备案的治疗中心有75家。
复星医药董事长吴以芳在8月30日下午的业绩会上提到,今年上半年散发的疫情对整个医疗板块影响还是比较大的,公司在上海的企业在生产制造时遇到一些情况,尤其是CAR-T。
按照药明巨诺和复星医药公布的数据,不考虑重叠医院的可能,目前两款在国内获批的CAR-T产品覆盖医院数量近200家。
除了上述两款已经在国内获批的产品,金斯瑞生物旗下的传奇生物(NASDAQ: LEGN)也有一款CAR-T疗法,今年2月末,传奇生物宣布,该疗法在美国获批,是首款获得FDA批准的国产CAR-T细胞疗法,也是全球第二款获批上市的BCMA靶向CAR-T疗法。
7月21日,金斯瑞生物科技曾公告称,其非全资附属公司传奇生物旗下CAR-T产品CARVYKTI截至2022年6月30日,季度产生贸易销售净额约2400万美元,约1.62亿元。
商保等创新支付方式推动CAR-T可及性
CAR-T疗法属于细胞免疫疗法,是在体外利用基因工程的方法修饰患者外周血T细胞,赋予T细胞靶向识别肿瘤细胞表面抗原的特性 ,经体外扩增培养后回输到患者体内进行治疗肿瘤的方法。
由于治疗潜力巨大,且有治愈肿瘤的可能,有人称之为“抗癌神药”,但同时,由于属于定制化疗法,该疗法的价格也颇为昂贵,未经报销的价格达到百万元级别,如何推进CAR-T疗法的可及性,成为包括企业在内的各方关注的问题。
复星医药在半年报中提到,截至2022年7月末,已列入44个省市的城市惠民保和超过50项商业保险。吴以芳在业绩会也提到,对于既往没有的,现在有创新支付的城市,能够报销相对30%以上的比例,不同的城市可能有不同,但是现在最低也没有低于30%,很大程度上解决了患者的负担。公司也在CAR-T的生产技术上进行持续的改进,不断优化生产和技术,希望能够尽可能降低成本,服务于更多患者。
药明巨诺方面,截至2022年6月30日,倍诺达已被列入52个商业保险产品及28个地方政府的补充医疗保险计划,有12名患者自该等保险计划获益。药明巨诺还提到,公司将继续与创新支付平台合作,这些公司能够向以倍诺达作为治疗手段的潜在接受者提供分期付款服务或抵押贷款。同时,将继续加强多层级医疗保障体系,减轻合资格接受倍诺达治疗的患者的负担。
此外,药明巨诺还提到,截至2022年8月,公司已经建立了一个由100名左右不同专业的员工组成的商业团队,涵盖销售团队、市场团队、CAR-T顾问团队、创新支付团队、渠道管理和医院准入团队。这些团队均由经验丰富的商业领袖带领, 且具备清晰的商业模式。

各家CAR-T疗法企业靶点对比 来源:华安证券研报
多款CAR-T疗法在研
从国际市场来看,CAR-T疗法的市场潜力巨大。以跨国药企百时美施贵宝(BMS)为例,旗下拥有两款已上市的CAR-T药物。半年报显示,Abecma半年销售额1.56亿美元,较去年同期的0.24亿美元增长550%;Breyanzi上半年销售额0.83亿美元,较去年同期0.17亿美元增长388%。
在CAR-T疗法的赛道,除了已经实现商业化的国产CAR-T产品,科济药业(2171.HK)、驯鹿生物、亘喜生物等多家药企也在推进CAR-T相关研发,如科济药业在半年报披露,CAR-T产品CT053计划于2022年第三季度向国家药品监督管理局提交新药申请,并计划于2023年向美国食品药品监督管理局提交生物药物上市许可申请。
8月20日,驯鹿生物宣布,国家药品监督管理局审评中心已正式审批通过其全人源BCMA嵌合抗原受体自体T细胞注射液新增扩展适应症抗体介导的视神经脊髓炎谱系疾病的临床试验申请。今年6月,该药治疗复发/难治性多发性骨髓瘤的新药上市申请获国家药品监督管理局正式受理并纳入优先审评。
华安证券研报提出,CAR-T技术平台与研发进展是各公司的核心竞争力,重点关注CAR-T技术平台先进、研发管线靠前、拥有差异性竞争优势的CAR-T公司。海通国际研报也指出,现有适应证竞争激烈、靶点集中(CD19、BCMA等),Biotech需要在红海市场中具有明显优势或者通过核心技术突破进入蓝海市场。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




