- +1
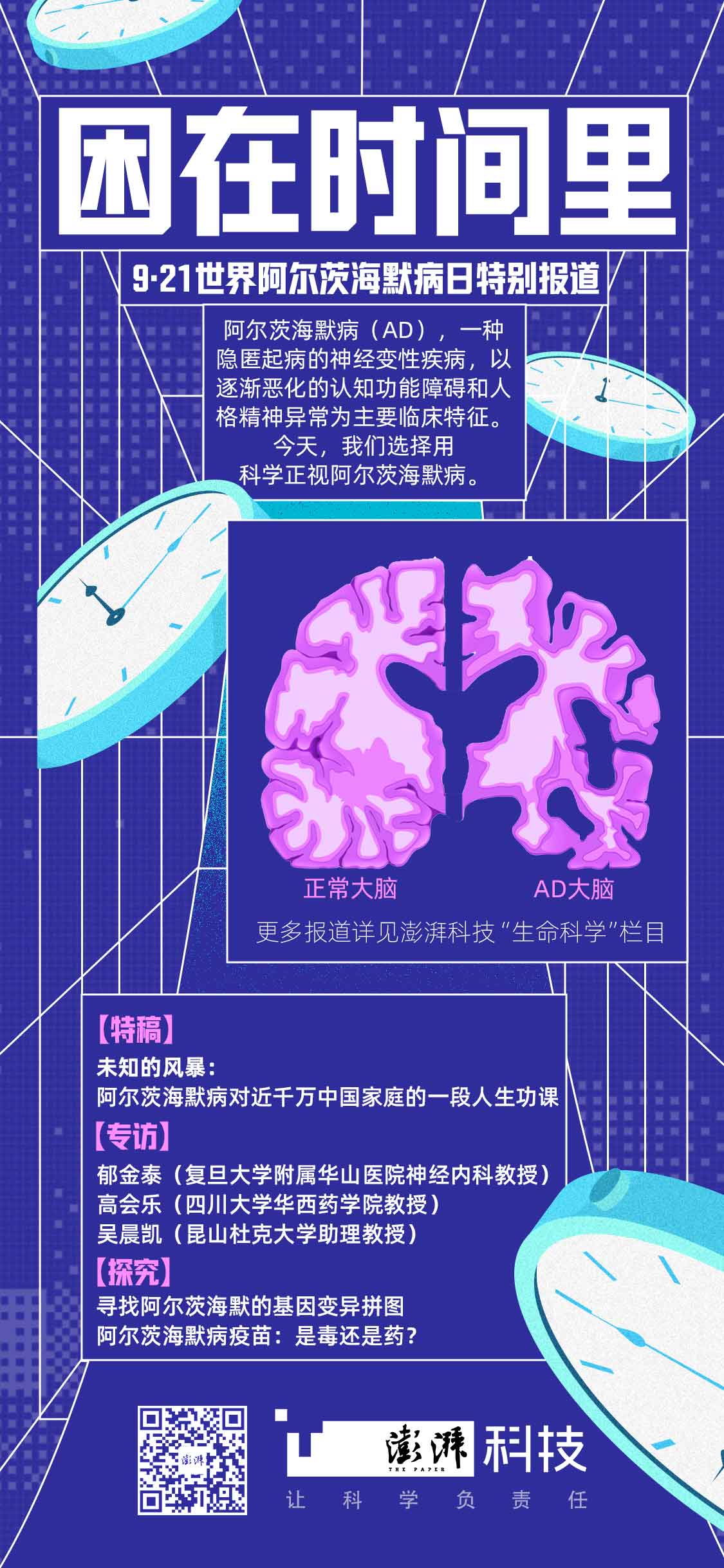
困在时间里|高会乐:纳米载体治疗阿尔茨海默病的潜力日益受关注
·纳米载体治疗阿尔茨海默病的潜力日益受到关注。它不仅有助突破脑部用药研发的“血脑屏障”难题,提高药物对脑部病灶区域的选择性,同时还可以联合药物进行多靶点治疗,进一步提高药物治疗的有效性。
·相比脑肿瘤而言,神经精神类疾病具有发病机制更加复杂、靶点不够明确、疾病持续时间更久等特征。
阿尔茨海默病是全球最常见的神经退行性疾病,病因和病理变化十分复杂。除了影响最大的靶标错误折叠蛋白(如Aβ淀粉样蛋白或Tau蛋白)之外,近年来临床研发越来越多转向突触活性和神经传导、炎症等更多机制的多点发力。
而随着纳米技术的发展,纳米载体治疗阿尔茨海默病的潜力也日益受到关注。它不仅有助突破脑部用药研发的“血脑屏障”难题,提高药物对脑部病灶区域的选择性,同时还可以联合药物进行多靶点治疗,进一步提高药物治疗的有效性。
四川大学华西药学院教授、青年长江学者高会乐,长期从事肿瘤靶向的纳米递药系统研究,并逐步聚焦到脑部肿瘤及脑部退行性疾病的靶向治疗上。近年来,高会乐不断探索高效跨越“血脑屏障”的靶向纳米递药系统开发,在阿尔茨海默病的靶向递药上取得许多突破。
2020年至2021年,高会乐课题组先后发表了酸响应的DGL纳米粒递送β分泌酶小干扰RNA(BACE1 siRNA)、ROS响应的PLGA纳米粒递送雷帕霉素的脑靶向递药系统,均显示出对阿尔茨海默病积极的治疗效果。
在这两项研究的基础上,课题组近期开发了一种鼻腔给药的脑靶向纳米递药系统,采用KLVFF肽和AAL修饰的DGL纳米粒,递送BACE1 siRNA和雷帕霉素进行联合治疗,显示出较好的鼻腔入脑效率和阿尔茨海默病灶部位的靶向效率。实验研究表明,该纳米粒能够在体内外诱导提高自噬水平,下调BACE1的表达,实现减少Aβ沉积、改善神经元病理变化、挽救阿尔茨海默小鼠记忆障碍的效果。
在第29个“世界阿尔茨海默病日”前夕,澎湃新闻连线高会乐教授,解析纳米递药系统用于阿尔茨海默病治疗的优势和前景。
对话:
澎湃科技:在阿尔茨海默症的机理研究方面,“Aβ淀粉样蛋白”假说尚未被证实。过去大量针对Aβ淀粉样蛋白的靶向药物临床实验效果不佳,你分析认为主要原因是什么?
高会乐:阿尔茨海默症的发病机理非常复杂,目前有多种假说,但都无法明确。“Aβ淀粉样蛋白”假说作为一个最知名的假说,得到了许多关注,但近期有研究表明Aβ淀粉样蛋白可能是阿尔茨海默症的“果”,而非“因”;同时阿尔茨海默症还具有Tau蛋白磷酸化、神经炎症等病理特征,因此针对单一疾病特征的治疗很难取得突破性的效果。据此我们认为,一方面需要对阿尔茨海默症的机理进行更多的深入研究,搞清楚发病机理;另一方面,在发病机理不明确的情况下,应当针对阿尔茨海默症的多种病理特征,开展联合治疗。
澎湃科技:纳米递药系统突破血脑屏障的机制是什么?和你过去研究的脑肿瘤方面的应用相比,神经精神类疾病有哪些特殊性,在这方面纳米药物的突出优势是什么?
高会乐:纳米递药系统突破血脑屏障的机制主要分为三种:1、利用内源性营养物质、激素等主动入脑的途径,依靠血脑屏障上高表达的受体、转运体等实现跨屏障转运,比如葡萄糖转运体可以将表面含有葡萄糖类似物的纳米药物转运入脑;2、采用物理或者化学的手段暂时性打开血脑屏障,比如采用局部聚集超声,可以使得血脑屏障细胞间隙变大,血液中的纳米药物则可漏进大脑;3、采用鼻腔给药,通过鼻脑通路直接入脑。
相比脑肿瘤而言,神经精神类疾病具有发病机制更加复杂、靶点不够明确、疾病持续时间更久等特征。纳米药物作为一种纳米尺度的药物“运输车”,可以将多个药物按照设定的比例递送到脑内,甚至可以实现多个药物的程序性释放,从而更加有利于神经精神类疾病的多药物联合治疗。另一方面,纳米药物提高药物在脑内分布也意味着药物在正常组织分布浓度降低,从而可以降低药物的毒副作用。
澎湃科技:目前国际上靶向阿尔茨海默病的纳米药物的研究进展如何?还有哪些问题需要解决?
高会乐:目前已有多种针对阿尔茨海默病的纳米药物,可以将小分子药物、多肽药物以及基因药物递送至脑内,并在动物研究中取得了较好的治疗效果。但普遍还存在以下问题:1、入脑量一般仅有1%-5%,效率还是不够高;2、靶向入脑的纳米药物设计较为复杂,在实验室可以进行,但进一步产品化比较困难;3、纳米药物在脑内的蓄积有可能产生毒性,纳米药物脑内代谢的研究较为缺乏。
澎湃科技:针对阿尔茨海默症的纳米递药系统开发,你在载体设计方面做了哪些探索和优化?
高会乐:我们团队主要开展了以下几个方面的探索:
1、提高跨血脑屏障转运效率。血脑屏障作为控制药物入脑的一道门,纳米药物既要在快速的血液循环中抓住门上的“把手”(也就是受体),又要在打开门后从“把手”上快速脱离,才能入脑。针对传统的受体介导的脑靶向纳米药物“结合容易、解离难”的问题,我们设计可响应性脱离的纳米药物,实现了“快速结合、快速解离”,显著提高了跨血脑屏障转运效率。
2、提高脑内病灶细胞的选择性。通过深入分析阿尔茨海默症病变部位血脑屏障的变化,以及神经细胞、小胶质细胞等目标细胞的特征,选择能够特异性结合病灶部位血脑屏障受体的分子,实现了更好的病灶选择性,可以将更多药物送入病灶,而非正常脑组织,达到增效减毒的效果。
3、研究了纳米药物出脑的路径。证明纳米材料可以通过类淋巴引流途径、外泌体介导的跨血脑屏障转运等途径排泄出脑,从而为纳米药物用于脑部疾病治疗的安全性提供了一定的依据。
澎湃科技:在众多可选的阿尔茨海默症靶向药中,你是如何选择适合纳米递送的药物的?
高会乐:我们一般根据药物的作用机制,选择具有协同效应、机制明确、活性较高的药物。比如针对阿尔茨海默症Aβ淀粉样蛋白沉积以及神经炎症的特征,我们选择了能够降低Aβ表达的siRNA药物和具有良好抗炎性能的雷帕霉素联合应用,既降低了脑内的Aβ水平,又改善了炎症状态,保护了神经系统,对阿尔茨海默症具有良好的治疗效果。
澎湃科技:你的团队开发的纳米递药系统在小鼠实验中取得了怎样的效果?目前已有模拟人类阿尔茨海默症的大鼠模型,你是否会考虑应用?这个纳米递药系统是否可能开展人类临床试验,在这方面未来你有哪些工作规划?
高会乐:我们设计的多个纳米药物在小鼠实验中取得了较好的治疗效果,如通过可以考察小鼠记忆性的水迷宫实验证明治疗后小鼠的记忆性得到有效提高,进一步通过组织切片等证明Aβ沉积显著降低、神经损伤得到有效改善。动物模型在药物开发中具有非常重要的作用,而能够接近人体疾病状态的动物模型更加重要。由于阿尔茨海默症发病机制不够明确,因此我们一直通过多个模型进行交叉验证,以期得到更为准确的结果。如果能够开发大鼠甚至大动物的模型,无疑会进一步促进纳米药物的研发。
这些纳米递药系统尽管还处在实验室研究阶段,但我们的最终目的肯定是希望应用于临床,能够切实改善病人的状况,提高人民生活质量。因此我们在未来会对纳米药物进行进一步优化,在提高脑内药物递送效率和阿尔茨海默症治疗效果的同时,优化递药系统设计,采用更加安全、可降解的药用辅料,并简化递药系统制备工艺,以期得到能够真正用于临床的纳米药物。
海报设计:澎湃新闻 祝碧晨





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




