- +1
Aβ与阿尔茨海默病,听听贾建平教授怎么说?
原创 医学界会议记录组 医学界神经病学频道 收录于合集 #第十五届中国医师协会神经内科医师年会(CNA 2022) 4个
*仅供医学专业人士阅读参考
 阿尔茨海默病的Aβ假说是否被推翻?一文带你解读,快来收藏吧!
阿尔茨海默病的Aβ假说是否被推翻?一文带你解读,快来收藏吧!阿尔茨海默病(Alzheimer’s disease, AD)是慢性进行性中枢神经系统变性病导致的痴呆,是痴呆最常见的病因和最常见的老年期痴呆。AD的确切发病机制尚不十分明确,多数被认为是老化、遗传和环境多种因素的共同结果。目前有多种学说,其中影响较广的是β类淀粉样蛋白(β amyloid peptide, Aβ)瀑布假说。
有趣的是,今年发表在Science(影响因子:63.832)杂志的题为《Blots on a field?》的文章,指出针对AD发病机制Aβ假说(主要针对Aβ*56)的原始研究涉嫌数据造假及捏造实验结果,质疑了该假说的真实性,一经发布,学术圈一片哗然,甚至质疑AD病理生理机制的真实性。那么,是否意味着阿尔茨海默病的Aβ假说已被推翻呢?
 图1:授课主界面(图源于贾建平教授授课PPT)
图1:授课主界面(图源于贾建平教授授课PPT)在2022年12月10日第十五届中国医师协会神经内科医师年会的认知障碍疾病分会场中,首都医科大学宣武医院贾建平教授做了题为“Aβ与阿尔茨海默病”的精彩授课,旨在分析Aβ假说的过去、现在和将来,让我们来一睹为快吧。
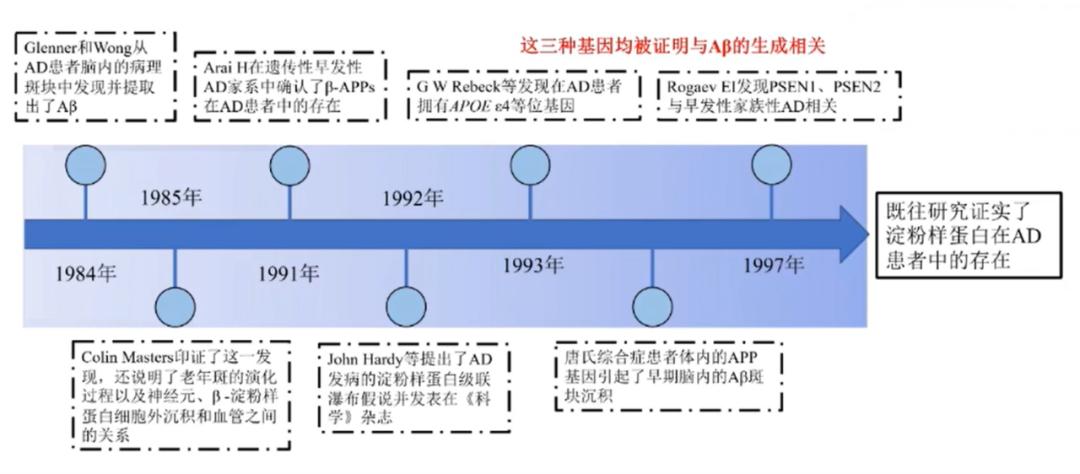 图2:Aβ假说起源历程(图源于贾建平教授授课PPT)
图2:Aβ假说起源历程(图源于贾建平教授授课PPT)贾建平教授认为,Aβ假说具有稳固的根基。从发展历程看,在1984年,Glenner等人从AD患者脑内病理斑块中提取出了Aβ;在1991年,Arai H在遗传性早发性AD家系中检测到了β-APPs在AD患者中的存在;在1992年,John Hardy等提出了AD发病的Aβ瀑布假说并发表在Science杂志上。所以,长期大量科学研究证实了Aβ在AD患者中的存在。
Aβ和认知能力下降之间
关键不在于Aβ*56
在1998年Lambert等人发现Aβ可溶性寡聚物的自发形成。此后Aβ寡聚物的毒性研究成为AD领域的重要方向,但何种Aβ寡聚形态导致认知能力下降仍不明确。在2006年,Lesné等人发现在AD临床前阶段与认知减退时间点发生同步改变的特定Aβ可溶性寡聚体(Aβ*56),可以作为新的靶点,但是研究论文中提出的这种关键分子蛋白印迹图片被质疑存在问题。在2008年,Dennis Selkoe直接从AD患者的大脑皮层中提取可溶性淀粉样蛋白低聚体(ADDL),但并没有在人类体液或组织中找到Aβ*56。这些发现似乎说明了Aβ*56存在问题。
贾建平教授认为,随着Aβ寡聚体研究的发展,Lesné等人发现的Aβ*56并没有成为今天支持Aβ积累和认知能力下降之间联系的理论的关键因素,而是迅速成为历史,其并未获得神经科学领域同行的广泛认可。简单地说,即便该研究结果真实性存在问题,也不能否认其他关于寡聚体毒性研究的结论。需要说明的是,在贾建平教授团队里关于AD的研究中也未发现Aβ*56的存在,这与国际上的部分研究结果一致。
Aβ在AD发病中
仍扮演者重要角色
AD的Aβ假说包含多个导致淀粉样斑块和纤维缠结的途径,Aβ*56只是其中一种。Aβ蛋白的错误折叠、聚集并生成富含β折叠结构的聚集体,并进而组装成淀粉样斑块在AD发病过程中扮演着重要角色。自从1992年John Hardy等提出了AD发病的Aβ瀑布假说,Aβ在AD病理生理过程中的作用得到了全球众多实验室成百上干次的实验验证,Aβ及寡聚体假说仍是AD领域研究中的重要假说。贾建平教授指出,Aβ有单体(单个肽单元)、二聚体、三聚体、四聚体、六聚体、九聚体、原纤维和淀粉样蛋白斑块等多种形式,而Aβ*56只是众多Aβ寡聚体的一种。同时他强调,目前认为Aβ1-40、Aβ1-42是AD发病的主要学说。
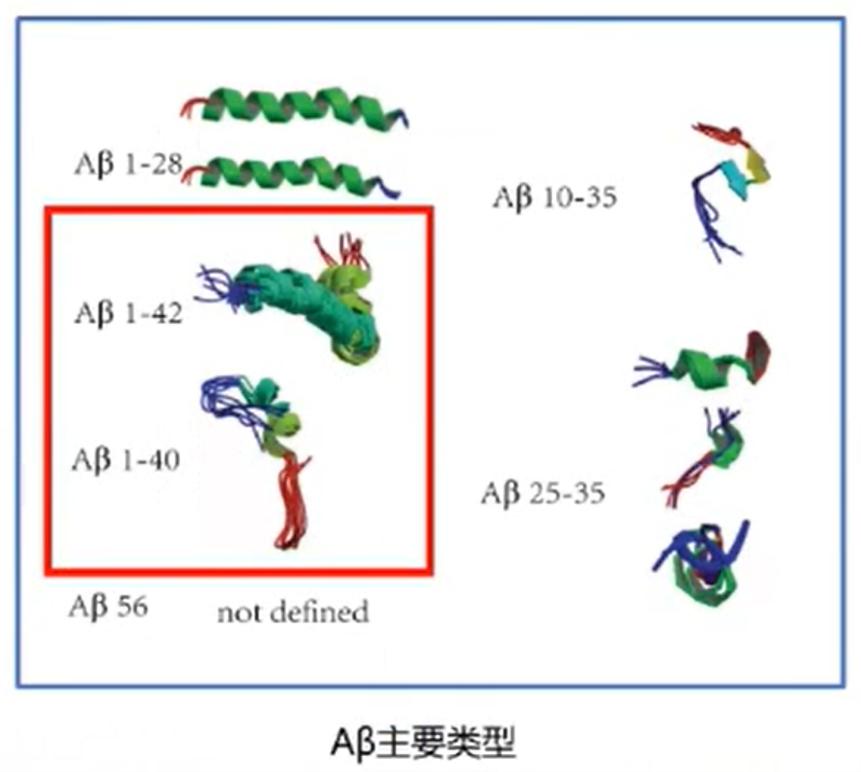 图3:Aβ主要类型(图源于贾建平教授授课PPT)
图3:Aβ主要类型(图源于贾建平教授授课PPT)Aβ寡聚体在纤维形成
过程中起着核心作用
AD病理改变与多种寡聚体相关。在患者AD额叶皮质样品中,在胞膜中鉴定出分子量为4至28kDa的多个代表Aβ单体和多聚体的条带。研究发现Aβ二聚体和五聚体水平与认知功能和突触损伤具有显著负相关性。贾建平教授强调,Aβ寡聚体通过多种途径引起AD病理改变。Aβ寡聚体可通过多种机制诱发毒性。在AD的早期阶段已经观察到Aβ寡聚体诱导的突触密度下降,在淀粉样斑块附近突触丢失的程度最大。
Aβ可自发聚集并形成纤维。Aβ的聚集过程是自催化的,大多数新的寡聚体是由现有原纤维表面的单体生成的。Aβ40、Aβ42是主要的聚集单体。构象的层次聚类表明,两种多肽都具有高自由能聚集倾向(N*)的状态。Aβ42肽的基极(RC)和N*状态之间的自由能差小于Aβ40,也意味着Aβ42相对于Aβ40更快的聚集速度。
Aβ的聚集包括三个阶段:初始滞后阶段、随后的生长阶段和最终的平稳阶段。Aβ寡聚体是Aβ纤维生成的必要中间体,主要存在于初始滞后阶段和生长阶段。贾建平教授指出,Aβ寡聚体在Aβ纤维生成过程中仍然起到核心作用。
Aβ蛋白聚集过程中产物毒性不同。最具毒性的Aβ形式可能不仅仅是斑块,而是Aβ寡聚体和原纤维的可溶性低分子量物质。Aβ毒性低聚物可能在8-24聚体之间。随着Aβ聚集体逐渐形成纤维,其毒性作用的效力下降。以上观点也在贾建平教授团队研究中得到证实。
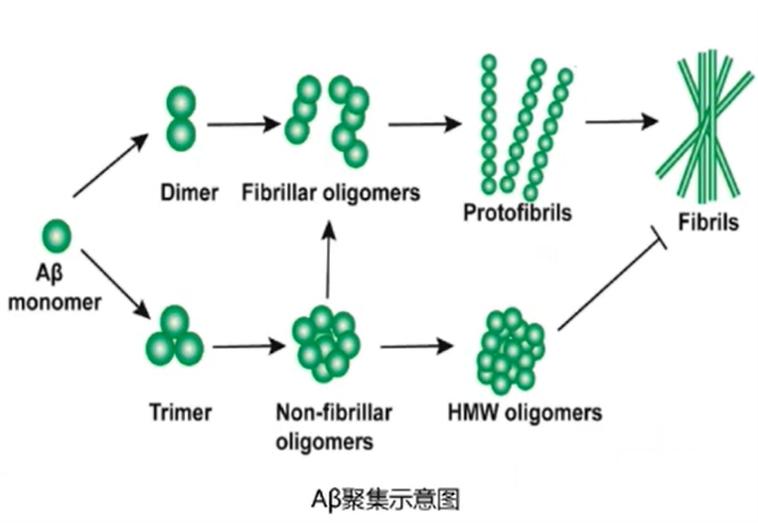 图4:Aβ聚集示意图(图源于贾建平教授授课PPT)
图4:Aβ聚集示意图(图源于贾建平教授授课PPT)外周Aβ种蛋白可导致
大脑AD样病理改变
具有自我复制聚集能力的Aβ蛋白称为Aβ种蛋白,包括Aβ寡聚体和Aβ原纤维。Aβ聚集体不仅存在于AD患者的脑内,而且存在于整个外周,包括血管组织、骨骼肌、胰腺和肝脏。通过腹腔、肌肉和眼部(滴眼液),注射含Aβ种蛋白的提取物可加速AD小鼠模型的脑淀粉样变。
Aβ能够有效反应AD病理变化
Aβ40/42是AD目前诊断的主要生物标志物。已经得到脑组织和外周血的证实。Aβ是AD的重要标志物。目前公认的观点是,Aβ斑块沉积标志物是目前可在体检测到的、最早出现的AD神经病理改变证据。贾建平教授强调,单独的Aβ异常即可作为AD的定义标志物。
Aβ沉积独立发生并最先上升到生物标志物检测阈值以上,并加速tau蛋白的病理改变。脑脊液Aβ42水平在预期症状发作至少15年前就出现下降。
基于Aβ聚集的Aβ种蛋白检测方法
贾建平教授表示其团队已研发出基于Aβ聚集的Aβ种蛋白检测仪器:AD蛋白错误折叠循环扩增仪,目前已获得良好的试验结果,结果发表于多篇国际高影响力杂志,为AD患者无症状阶段的早期诊断提供了有力工具。AD早期微量的致病关键分子Aβ种蛋白从脑内循环至体液,通过检测体液中Aβ种蛋白可对AD患者进行早期诊断。我们基于蛋白循环扩增(PMCA)原理,自主研发了实时定量检测Aβ种蛋白的扩增仪,能够准确检测体液Aβ种蛋白的动态变化及微量差异,满足临床需求,使AD在早期得到诊断和干预。该团队首次建立外周血中Aβ种蛋白检测方法,并为AD的早期诊断提供了新手段。
靶向Aβ仍是最有希望的
预防和治疗AD方法之一
目前AD三期临床药物试验中,大约19%(6/31)的药物是基于淀粉样蛋白假说研发的,主要是靶向Aβ斑块或是影响Aβ的形成,没有Aβ*56特异性的药物。目前也没有患者进入基于Aβ*56观察的试验。Aβ和认知能力下降之间关键不在于Aβ*56。
目前临床试验中针对Aβ蛋白的治疗策略包括靶向APP加工、被动免疫的调节剂、靶向Aβ错误折叠和寡聚体形成的抑制剂、肠道微生物群调节剂、Aβ聚集抑制剂和Aβ清除促进剂等。近期仑卡奈单抗的成功无疑给抗Aβ药物注射了一剂“强心针”。靶向Aβ相关的神经元功能障碍仍然是该领域预防和治疔阿尔茨海默病的重要方法之一。
最后,贾建平教授指出,AD病理机制十分复杂,针对AD的多靶点、联合用药是治疗AD的关键。
为了能更好地为大家提供有趣、有用、有态度的内容,“医学界神经病学频道”欢迎大家动动手指完成以下的调研,只要十秒钟哦!
本文来源丨医学界神经病学频道
会议讲者丨贾建平教授 首都医科大学宣武医院
本文整理丨医学界会议记录组
责任编辑丨陆离先生
版权声明
本文原创,转载请联系授权
-End-
往期精彩回顾
投稿/转载/商务合作,请联系:yxjsjbx@yxj.org.cn
* "医学界"力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
原标题:《Aβ与阿尔茨海默病,听听贾建平教授怎么说?》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




