- +1
【学术前沿】STTT丨卞修武等团队合作揭示COVID-19脑损伤病理机制
新型冠状病毒SARS-CoV-2引起的冠状病毒病2019 (Coronavirus disease 2019, COVID-19) 造成了全球大流行,迄今仍给人类生命健康造成严重威胁。现有研究已经证实,COVID-19患者体内多器官可感染病毒,并导致包括呼呼吸系统在内的多器官损伤和衰竭【1-3】。值得关注的是,部分COVID-19患者,特别是老年和有基础病的人群会伴有神经系统临床表现,其发生机制未明。尽管动物和类器官模型实验提示SARS-CoV-2病毒具有感染神经组织的能力,但已报道的脑病变与神经系统临床表现严重程度和病毒载量不相关。因此,以下问题亟须深入研究:(1)COVID-19脑损伤的病理学性质及炎症机制究竟是什么?(2)COVID-19累及的脑神经元、神经胶质细胞及血脑屏障损伤的分子基础是什么?(3)COVID-19脑损伤与老年性脑改变的关系和差异是什么?
2023年1月6日,来自中国科学技术大学和陆军军医大学等单位的联合研究团队在Signal Transduction and Targeted Therapy杂志上在线发表了题为COVID-19-associated monocytic encephalitis (CAME): histological and proteomic evidence from autopsy的研究论文。作者通过对比研究老龄COVID-19和正常老龄脑的神经病理学改变和蛋白质组学图谱,确定了COVID-19相关单核细胞性脑炎(COVID-19-associated monocytic encephalitis, CAME)病理诊断及其分子病理学特征,揭示了以单核细胞为主的炎细胞浸润、小胶质细胞活化和炎性因子释放导致脑细胞及血脑屏障破坏,是CAME发生的重要机制,并可能成为COVID-19的治疗靶点。
 作者对2020年武汉疫情期间尸检的COVID-19脑(9例)各脑区(每例取14个脑区)进行组织病理学、超微结构、病毒检测(核酸和蛋白)检查,发现脑病变主要表现为噬神经细胞现象(neurophagocytosis)、卫星现象 (satellite phenomena)、小胶质结节 (microglia nodules) 形成,并有明显的血管炎、血管源性脑水肿及炎细胞浸润。免疫组化标记及计算机辅助的定量病理学分析结果显示,在血管周围间隙和脑实质内存在单核细胞浸润,表达CD14/CD16/CD141/CD11c/CCR7,并且呈活化表型;同时血管壁及血管周围也存在CD4/CD8、CD20阳性淋巴细胞;星形胶质细胞和小胶质细胞增生和活化表现。内皮细胞肿胀、细胞连接破坏、基底膜肿胀以及胶质膜水肿、断裂不连续。上述病理变化呈现单核细胞性脑炎特征。此外,部分患者可见灶性脑出血、脑软化、坏死性血管炎或脑炎,肺部合并有细菌性肺炎的病例可见脑膜脑炎。脑微血管内皮细胞免疫染色可见病毒蛋白阳性。
作者对2020年武汉疫情期间尸检的COVID-19脑(9例)各脑区(每例取14个脑区)进行组织病理学、超微结构、病毒检测(核酸和蛋白)检查,发现脑病变主要表现为噬神经细胞现象(neurophagocytosis)、卫星现象 (satellite phenomena)、小胶质结节 (microglia nodules) 形成,并有明显的血管炎、血管源性脑水肿及炎细胞浸润。免疫组化标记及计算机辅助的定量病理学分析结果显示,在血管周围间隙和脑实质内存在单核细胞浸润,表达CD14/CD16/CD141/CD11c/CCR7,并且呈活化表型;同时血管壁及血管周围也存在CD4/CD8、CD20阳性淋巴细胞;星形胶质细胞和小胶质细胞增生和活化表现。内皮细胞肿胀、细胞连接破坏、基底膜肿胀以及胶质膜水肿、断裂不连续。上述病理变化呈现单核细胞性脑炎特征。此外,部分患者可见灶性脑出血、脑软化、坏死性血管炎或脑炎,肺部合并有细菌性肺炎的病例可见脑膜脑炎。脑微血管内皮细胞免疫染色可见病毒蛋白阳性。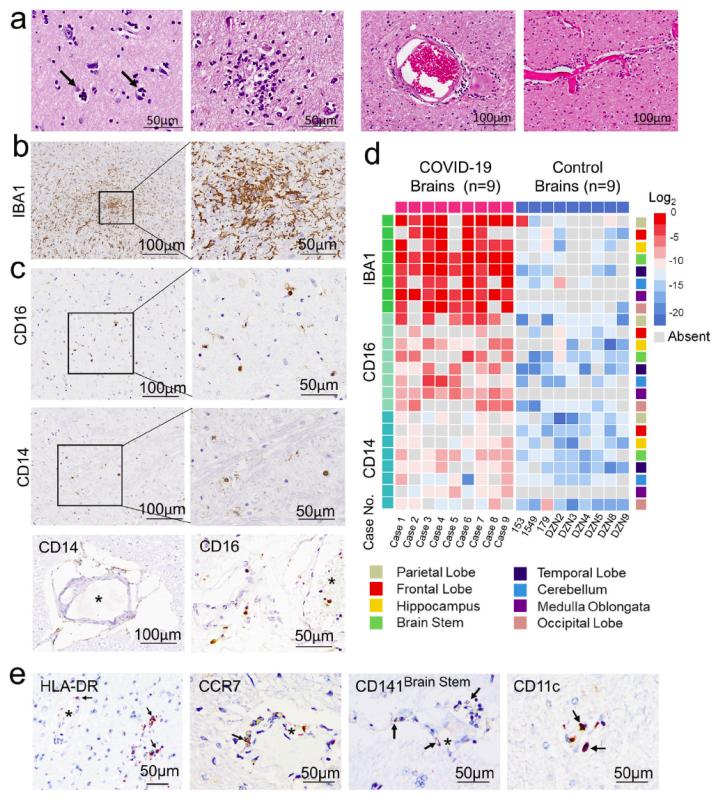 图1 COVID-19脑组织病理学改变,单核细胞浸润和小胶质细胞增生活化。
图1 COVID-19脑组织病理学改变,单核细胞浸润和小胶质细胞增生活化。为了了解COVID-19患者脑组织中炎细胞的作用机制,作者对COVID-19脑与正常脑(9例)各脑区进行蛋白质组检测和比较分析,结果显示,与正常对照脑组织相比,COVID-19脑中存在572个差异表达的蛋白。其中表达上调的294个蛋白主要富集在JAK-STAT、Toll样受体TLR1/TLR2、NFκB磷酸化、IKKs复合物活化和MHC II类抗原提呈等多种免疫反应相关的信号通路。此外,发现了可能驱动这些免疫信号通路活化的炎症因子。例如,IL-12刺激激活JAK-Stat通路的蛋白(PITPNA, CDC42, RAP1B, CFL1, RPLP0, SNRPA1, SOD2, RALA, PPIA);促使单核细胞趋化蛋白1产生的蛋白(HMGB1和APOD)等。蛋白质组学的结果支持COVID-19患者脑中的小胶质细胞和星形胶质细胞活化后释放的炎性因子可能引起脑损伤,影响脑的细胞连接、能量代谢和认知记忆等功能。
组织学形态及超微结构均提示COVID-19脑的血脑屏障受损,蛋白组结果显示血脑屏障的重要组成部分——血管基底膜成分的缺失。例如,层粘连蛋白家族(LAMB2、LAMA2、LAMC3、LAMB1、LAMC1和LAMA5)、蛋白聚糖家族(COL18A1、HSPG2和AGRN)和基底膜特定胶原蛋白(IV、V、VIII和XVIII型),这些作为基底膜成分对血管内皮细胞进行物理支撑和功能调控的细胞外基质蛋白在COVID-19脑中严重表达下调。此外,研究者还发现PDGFRβ、EGF/EGFR和VEGF信号通路的异常激活以及Wnt和Hedgehog信号通路的失调,可能导致COVID-19血脑屏障相关分子异常表达。黏附连接、溶质载体、紧密连接、外排泵、物质转运和囊泡介导转运等维持血脑屏障完整性和功能性的相关分子均表达异常。以上结果揭示了与BBB发病机制相关的蛋白质谱这可能会加剧CAME的发生。
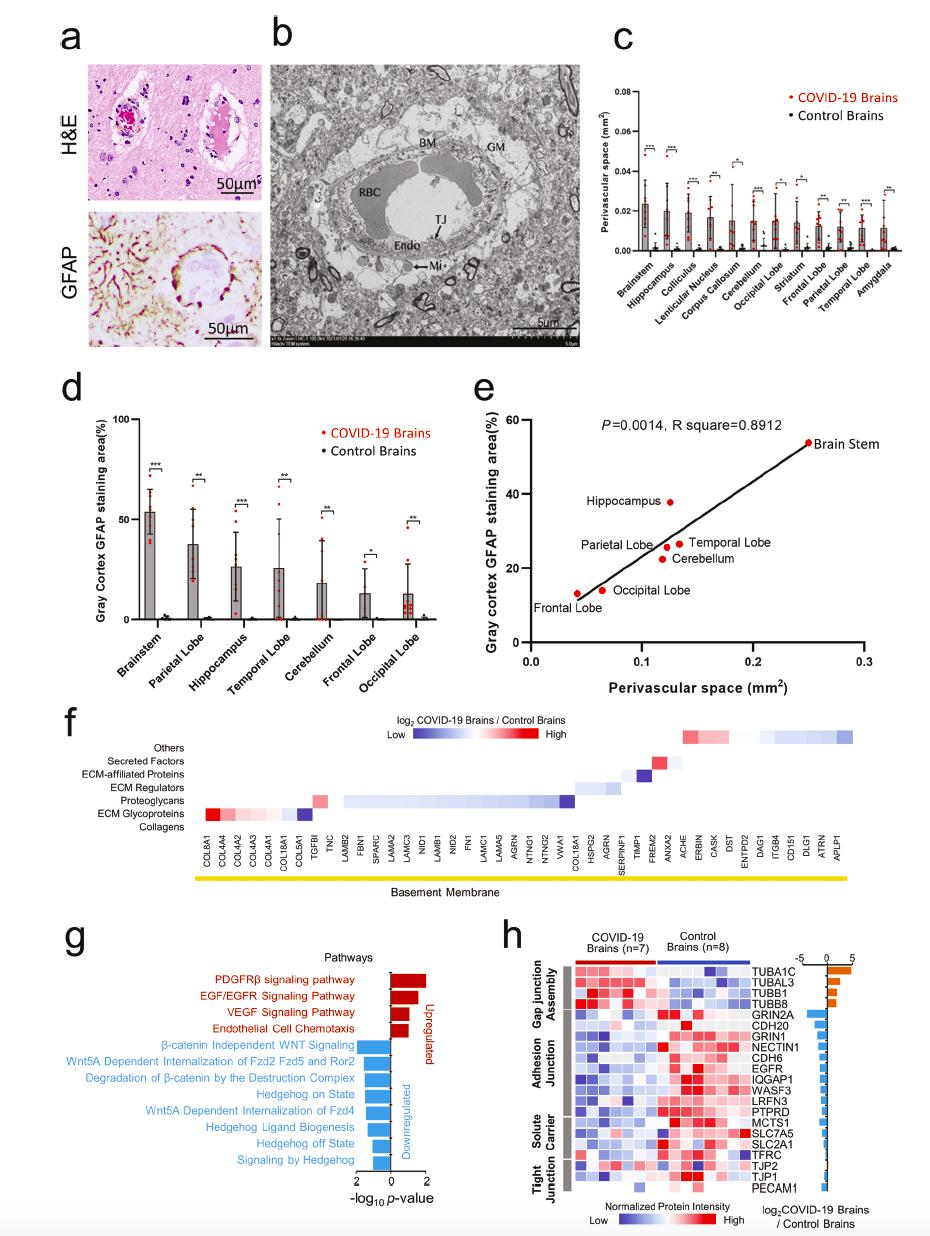 图2 COVID-19脑炎血脑屏障损伤及相关蛋白质组学改变
图2 COVID-19脑炎血脑屏障损伤及相关蛋白质组学改变为了验证上述神经病理损伤机制,作者原位检测了与CAME相关的炎性介质,结果发现,COVID-19脑中IL-4、IL-6、IL-8、IL-12、TGF-β和TNF-α相关通路的表达水平上调,以上细胞因子主要在血管内皮细胞、单核细胞、淋巴细胞和小胶质细胞上表达。有意思的是,以上主要炎性介质在脑与肺和肝脏中的表达趋势高度一致,表明这些因子可能参与了系统性炎症因子风暴。
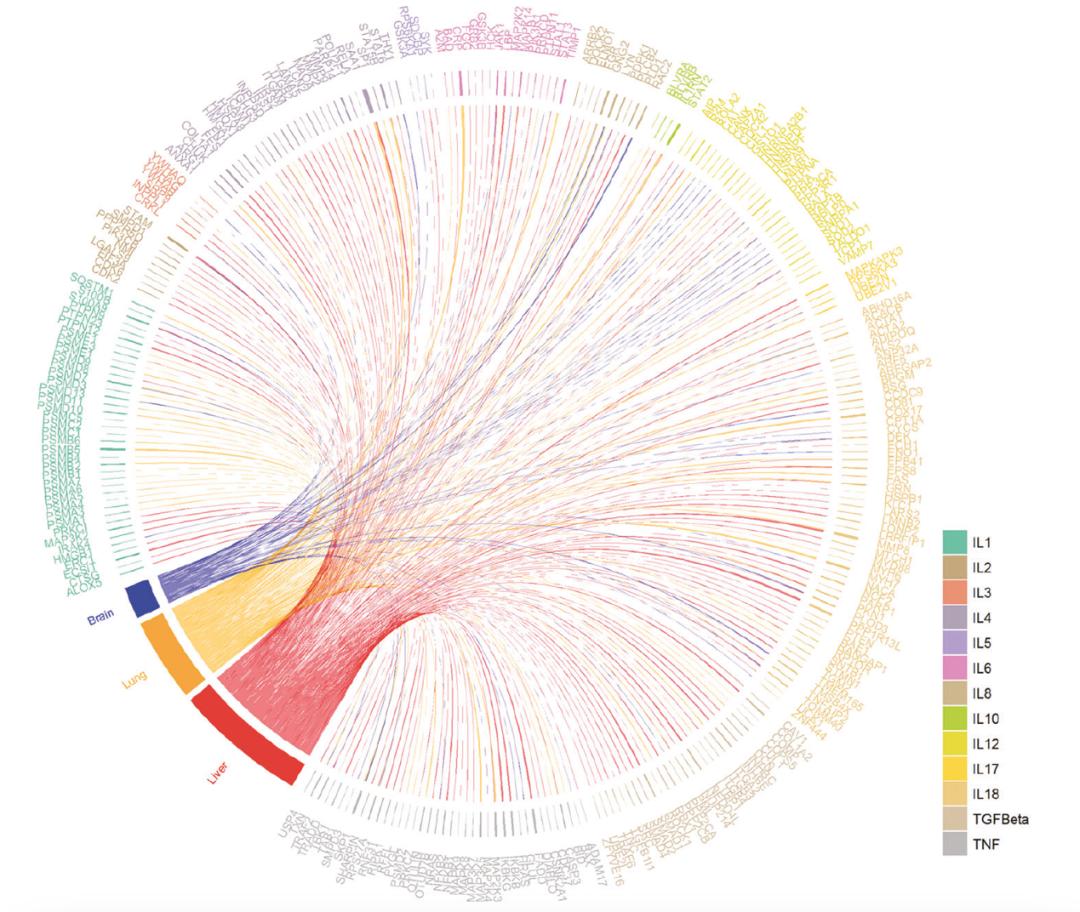 图3 COVID-19脑炎蛋白质组学与肺和肝蛋白质组学的关系。
图3 COVID-19脑炎蛋白质组学与肺和肝蛋白质组学的关系。COVID-19患者脑中还出现缺血缺氧性急性脑损伤病变,包括灰质神经元红色变、尼氏体溶解、小脑浦肯野细胞和颗粒细胞数量减少。白质髓鞘肿胀、断裂或脱失。蛋白质组学揭示神经系统功能相关的通路,如逆行神经营养素信号传导、神经保护和脑源性神经营养因子信号通路严重下调。进一步,研究发现COVID-19脑组织细胞对营养缺乏导致的自噬、缺氧反应和病毒感染的相关蛋白上调,说明自噬、病毒感染和缺氧反应可能是导致神经系统功能受损的原因。此外,研究还发现COVID-19脑组织中能量代谢相关蛋白高度富集,这可能是由于自噬导致的。
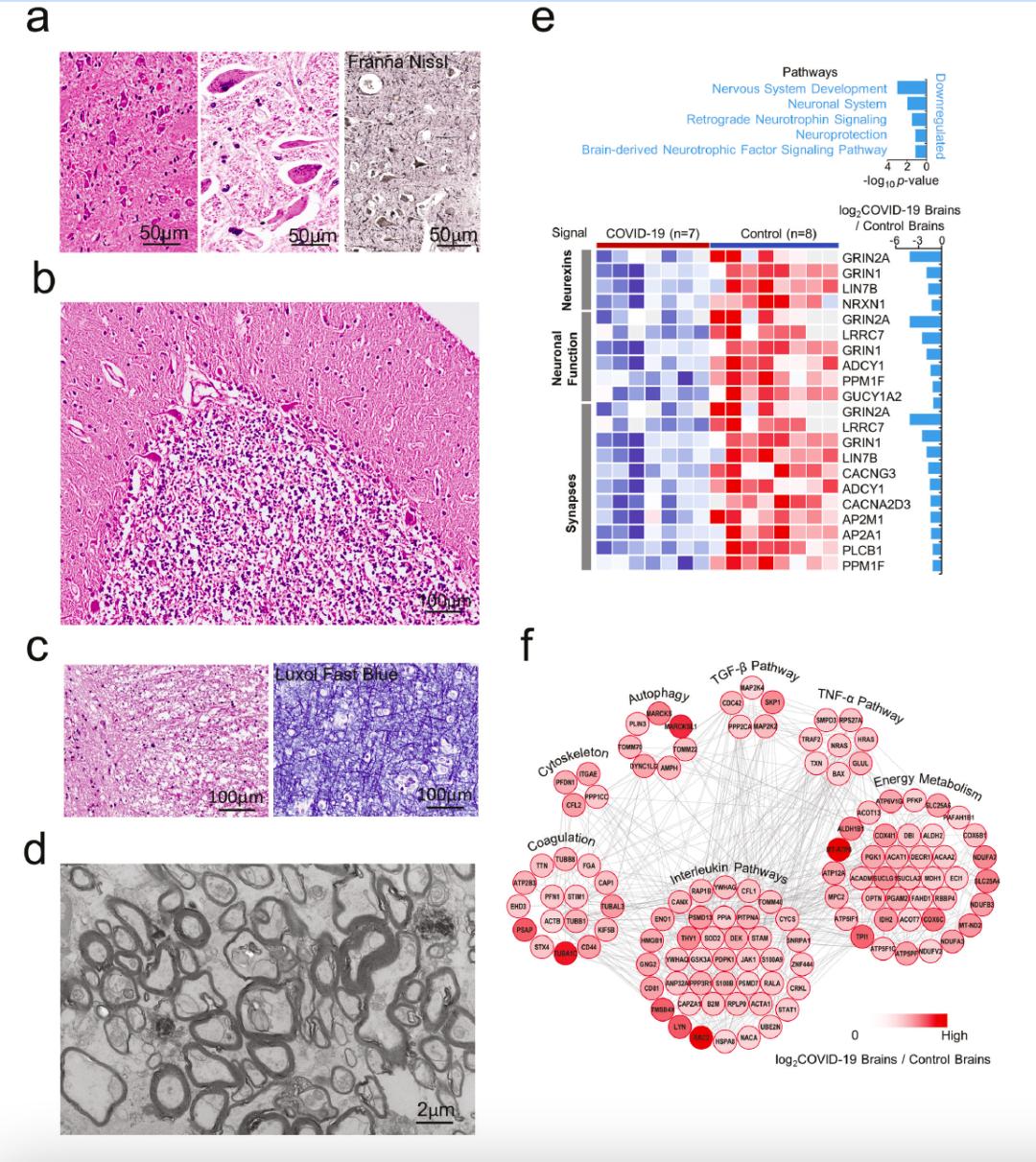 综上所述,作者系统对比研究了COVID-19和对照组脑的神经病理学改变和蛋白质组学图谱,定义了COVID-19相关单核细胞性脑炎(COVID-19-associated monocytic encephalitis, CAME)。本研究首次为COVID-19脑损伤提供了脑空间蛋白质组学的分子基础,揭示了CAME发病机制和潜在治疗靶点。
综上所述,作者系统对比研究了COVID-19和对照组脑的神经病理学改变和蛋白质组学图谱,定义了COVID-19相关单核细胞性脑炎(COVID-19-associated monocytic encephalitis, CAME)。本研究首次为COVID-19脑损伤提供了脑空间蛋白质组学的分子基础,揭示了CAME发病机制和潜在治疗靶点。该研究由中国科学技术大学附属第一医院、陆军军医大学第一附属医院、北京协和医院、上海交通大学医学院附属瑞金医院和武汉金银潭医院等单位联合完成。卞修武(中国科学技术大学/陆军军医大学)、冷冷(北京协和医院)、平轶芳和姚小红(陆军军医大学)为共同通讯作者,张培培(中国科学技术大学博士生)为第一作者。
原文链接:
https://www.nature.com/articles/s41392-022-01291-6
相关文献
1. Stein SR, et al. Nature, 2022, 612(7941):758-763.
2. Yao XH, et al. Cell Res, 2021, 31(8):836-846.
3. Wang S, et al. Nat Cell Biol, 2021, 23(12):1314-1328.
原标题:《【学术前沿】STTT丨卞修武等团队合作揭示COVID-19脑损伤病理机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




