- +1
陈昶/刘海鹏/费义艳/戈宝学合作发现Brivanib可靶向cGAS激活抗肿瘤免疫增敏化疗
原创 Cell Press CellPress细胞科学

生命科学 Life science
以铂类为基础的化疗是肺癌患者最有效的治疗策略之一。然而,化疗失败或者化疗低反应极大限制了铂类化疗药的临床治疗疗效。有证据表明I型干扰素在动物实验和临床研究中均可提高铂类化疗药物的抗肿瘤疗效。因此,筛选出cGAS激动剂,利用cGAS介导的抗肿瘤免疫应答来桥接化疗引起的DNA损伤可能是一种很有前景的化疗增敏策略。本研究旨在通过高通量筛选cGAS激活剂,实现化疗增敏,改善患者预后。
2023年3月20日,同济大学附属上海市肺科医院陈昶教授、刘海鹏研究员、戈宝学教授和复旦大学费义艳教授合作在Cell Press细胞出版社期刊Cell Reports上发表了题为“Pharmacological boosting of cGAS activation sensitizes chemotherapy by enhancing antitumor immunity”的研究成果。该研究利用高通量技术筛选可与cGAS结合的化合物,最终发现Brivanib(血管内皮细胞生长因子受体和成纤维细胞生长因子受体的双靶点抑制剂)为cGAS的新型增效剂,在体外和体内水平以cGAS依赖的方式显著增强肿瘤细胞中铂类化疗药诱导的STING-TBK1-I型干扰素反应,协同促进抗肿瘤免疫应答,显著提升化疗敏感性。该研究创新性地表明了小分子化合物可能通过类似“分子胶水”方式促进DNA和cGAS结合,进而增强cGAS活性的全新路径,并为铂类药物化疗增敏提供候选药物。
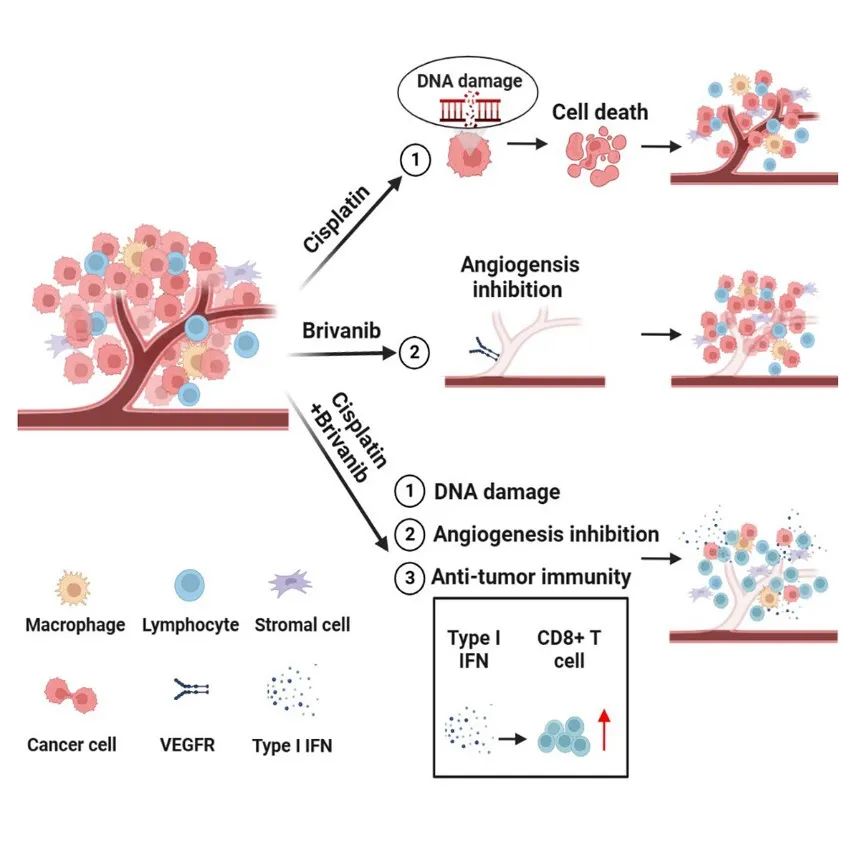
图1 铂类化疗药物和Brivanib协同抗肿瘤的作用机制
顺铂等铂类化疗药物和Brivanib分别通过诱导DNA损伤和抑制血管生成发挥抗肿瘤作用,两者联合治疗可提高I型干扰素反应至一定阈值,从而促进抗肿瘤免疫应答,发挥协同抗肿瘤作用。
首先,该研究利用斜入射反射率差(oblique-incidence reflectivity difference,OI-RD)和高通量小分子芯片(small-molecule-microarray,SMM)的方法,筛选可与cGAS蛋白结合的小分子化合物,最终明确Brivanib可结合cGAS并靶向增强其I型干扰素诱导能力。在细胞水平,Brivanib以cGAS依赖的途径,显著增强肿瘤细胞中铂类化疗药诱导的STING-TBK1-I型干扰素反应。重要的是,Brivanib可与顺铂发挥协同抗肿瘤效应,以cGAS依赖性方式增强CD8+T细胞反应来抑制小鼠LLC肺癌细胞皮下肿瘤的生长。此外,与北京大学未来技术学院席建忠教授团队合作,该研究在国际上首次引入肺癌人源微肿瘤模型(patient-derived tumor-like cell clusters,PTCs)并进行药物疗效评估。PTCs模型是一种人源化肿瘤模型,是由原发肿瘤的上皮细胞、成纤维细胞和免疫细胞自组装和增殖形成的肿瘤模型,该模型在结构和功能上都可以高度还原人体内原发肿瘤。PTCs药效疗效评估实验表明,当PTC中cGAS高表达时,Brivanib与顺铂发挥协同作用,显著抑制PTC中的肿瘤生长,但当cGAS低表达或不表达时,Brivanib与顺铂没有明显协同抗肿瘤效果,表明cGAS表达对Brivanib和顺铂在肿瘤治疗中的协同作用至关重要。
机制上,研究者发现Brivanib可能通过直接靶向cGAS的亮氨酸495位点增强了cGAS与DNA的结合力。cGAS的亮氨酸495位点对于Brivanib促进顺铂诱导的I型干扰素反应和协同抗肿瘤效果至关重要。临床上,肿瘤组织高表达cGAS的肺癌患者对铂类化疗方案的反应更好,预后更佳。该研究明确了cGAS是Brivanib的新靶点,并为Brivanib与铂类化疗药物联合用于肺癌治疗提供了依据。同时明确了小分子化合物可通过促进cGAS DNA结合能力增强其免疫活性,为靶向cGAS增强抗肿瘤免疫力来改善化疗疗效提供了新思路和新工具。
据悉,同济大学附属上海市肺科医院陈昶教授、刘海鹏研究员、戈宝学教授和复旦大学费义艳教授为本文的共同通讯作者,该工作主要由博士生苏杭、王菲、党艺方和任怡久共同完成。该研究得到北京大学未来技术学院席建忠教授、华东师范大学吴俊教授、南京大学医学院附属鼓楼医院许柱博士和同济大学附属上海市肺科医院苏春霞教授、武春燕教授的大力支持和帮助。
作者专访
Cell Press细胞出版社公众号特别邀请陈昶教授和刘海鹏研究员代表研究团队接受了专访,分别从临床和基础两方面为大家进一步详细解读。
CellPress:
为什么会开展该项研究?
陈昶教授:
以铂类为基础的化疗方案仍然是肺癌患者最有效的治疗策略之一,但是化疗耐药是个亟待解决的临床难题。前期已有动物实验和临床研究表明I型干扰素可提高铂类化疗药物的抗肿瘤疗效,而铂类化疗药物抗肿瘤的一个重要机制就是诱导DNA损伤。近年来的研究表明,DNA受体cGAS可感知基因组不稳定并激活I型干扰素免疫应答。那么,理论上,筛选出cGAS激动剂,可以进一步强化化疗药物诱导的cGAS活化,协同增强抗肿瘤免疫应答,可能是一种很有前景的化疗增敏策略。所以我们开展了这项研究,旨在运用我们前期建立的高通量筛选平台体系,发现cGAS激活剂,实现化疗增敏,提高患者预后。
CellPress:
这一研究的发现主要有什么意义?
陈昶教授:
cGAS是非常重要的抗肿瘤药物研发靶点,但其激活剂的研发并不十分成功,目前还处于一个早期探索的阶段。我们这项研究主要整合了复旦大学费义艳教授研发的斜入射反射率差(oblique-incidence reflectivity difference,OI-RD)和高通量小分子芯片(small-molecule-microarray,SMM)筛选平台的优势,优先筛选cGAS结合小分子并进行功能验证,最终发现的Brivanib这个新型cGAS激活剂。Brivanib是抗肿瘤血管领域的“老药”,主要通过抑制血管生成发挥抗肿瘤作用,而顺铂等铂类化疗药物诱导DNA损伤和肿瘤细胞凋亡。肿瘤细胞响应铂类药物产生的I型干扰素免疫应答往往并不足以激发抗肿瘤免疫,两者联合治疗可显著增强I型干扰素反应,产生协同抗肿瘤效应,发挥1+1>2的作用。我们这个研究发现Brivanib可以发挥“一石二鸟”功效,除靶向抑制血管生成,还可以靶向cGAS增强抗肿瘤免疫应答,为Brivanib应用于肿瘤的临床治疗提供了强有力的理论证据。
CellPress:
你们发现的这一cGAS小分子激活剂有何特色?
刘海鹏研究员:
我们通过高通量筛选和功能验证,发现传统的抗血管生成小分子Brivanib可以靶向cGAS,通过促进其与DNA的结合增强其I型干扰素免疫应答的诱导能力。已有报道cGAS与DNA的结合能力可以被多种方式调控,比如cGAS的蛋白翻译后修饰、伴侣蛋白、相分离、Mn2+等。我们前期也发现PARP1介导cGAS的PARylaiton修饰可以阻断cGAS的DNA结合能力。这些工作都提示,cGAS的DNA结合能力是一个可以被调控的过程。我们这项研究,发现了通过小分子类似以“分子胶水”的方式,促进cGAS和DNA的结合,以全新的方式放大cGAS激活效应,这也为未来通过其他方式促进cGAS和DNA结合来激活cGAS及下游信号通路提供了概念验证。
CellPress:
你们后续工作有何打算?
刘海鹏研究员:
基于这项工作,非常值得进一步围绕Brivanib在铂类化疗增敏中的相关临床研究。值得注意的是,先前有研究者报道cGAS对于免疫检查点抑制剂治疗在小鼠中的抗肿瘤免疫治疗中至关重要,激活cGAS-STING信号通路或许可以提高免疫检查点抑制剂的治疗效果。以PD-1及配体PD-L1为代表的免疫检查点抑制剂虽然改变了肺癌临床治疗的格局,然而,仅约20%患者可以从免疫治疗中获益,大多数肺癌患者对免疫检查点抑制剂治疗效果仍不理想。因此,Brivanib与免疫检查点抑制剂联合治疗,有望增加患者对免疫检查点抑制剂治疗反应,扩大免疫检查点抑制剂治疗的获益人群,未来值得深入研究。
我们前期围绕cGAS的功能及靶向干预开展了一系列的研究工作,特别是在国际上率先系统阐释了核内cGAS抑制DNA修复的全新功能与机制。近年来关于cGAS核内功能的研究取得了重要进展。然而,染色质结合的cGAS是否直接参与基因转录调控等生物学过程仍亟待回答,未来我们将会针对这一方向进行探究。

作者介绍

陈昶
教授
陈昶,教授、博士生导师、主任医师,享国务院特殊津贴、入选国家百千万人才工程、上海领军人才、上海市优秀学科带头人
现任职务及专业学术任职
行政职务:上海市肺科医院党委书记、上海肺移植工程技术研究中心主任、同济大学胸外科临床研究中心主任
学术任职:
中华医学会胸心血管外科分会青年医师委员会副主任委员(第九届)
上海医学会胸外科分会副主任委员
上海市医师协会胸外科医师分会副会长
中国医促会胸部肿瘤分会副主任委员
上海市医学会器官移植分会委员
上海医药行业协会规范化诊治专业委员会委员
海峡两岸医学交流会胸外科分会副主任委员
美国胸心外科学会国际会员(AATS Membership)
国际肺癌研究协会会员 (IALSC Membership)
美国胸外科医师协会会员 (STS Membership)
美国外科学会会员(ACS Membership)
英国皇家外科医学院会员(RCS Membership)
科研项目及成果
主持国家重点研发项目、国家自然科学基金重大项目、上海市科委等课题10余项。近5年以通讯作者发表 SCI 论文 132 篇,单篇最高 44 分,包括J Clin Oncol, MOL Cancer, J Thorac Oncol, JAMA SURGERY等著名国际期刊。获专利22项,软件著作权2项。科研成果荣获省部级奖励8项,包括教育部科技进步奖二等奖、上海市科技进步一等奖等。编写胸部肿瘤外科专著7部,包括英文论著2部,参与制定专家共识4项,共同创办英文期刊Current Challenges in Thoracic Surgery。

刘海鹏
研究员
刘海鹏,研究员,博士生导师。同济大学附属上海市肺科医院中心实验室副主任,兼任临床医学转化中心副主任。上海市结核病快速检测与药物筛选专业技术服务平台主任。中国抗癌协会肿瘤微环境专委会青年委员,上海市免疫学会感染免疫专委会委员,上海抗癌协会转化医学专委会常务委员。国家自然科学基金优秀青年基金获得者(2019年);入选上海市“曙光计划”(2020年)、“上海市浦江人才”计划(A类)(2016年)。
主要研究方向为肺部肿瘤与肺部感染的基础和转化研究,以固有免疫分子为切入点,致力于疾病靶标的发现与干预。近年来聚焦目前广受关注的DNA受体环鸟苷酸-腺苷酸合成酶(cyclic GMP-AMP synthase,cGAS),系统阐释了cGAS细胞核内抑制DNA修复的全新功能与机制,为肿瘤治疗提供了理论基础与重要靶标(Nature,2018;Nature Reviews Molecular Cell Biology与Cancer Discovery亮点报道)。此外,发现cGAS可识别细胞外环核苷二磷酸,激活固有免疫应答,从而将cGAS识别的病原相关分子模式从dsDNA拓展到CDNs,对于将CDNs应用于疫苗与癌症免疫治疗具有重要参考价值(EMBO Reports,2019;F1000推荐)。研究发现cGAS可以发挥微核自噬受体功能,调控微核稳态平衡(Autophagy,2021)。最近发现cGAS可被PARP1介导发生PARylation修饰(Molecular Cell,2022)。此外,开发了靶向cGAS-STING信号通路的小分子药物(EMBO reports,2022;Cell reports, 2023;Signal Transduction and Targeted Therapy,2023)。另外,还以重要病原菌结核分枝杆菌(MTB)为研究模型,发现了多个参与MTB识别的受体(EMBO Reports, 2021; Nature Communications, 2018; The Journal of Immunology, 2017)。目前已在Nature、Molecular Cell、Nature Communications、Autophagy、EMBO Reports(3)等发表第一作者(含共同)、共同通讯作者论文24篇;授权发明专利4项,参与获得教育部自然科学一等奖。研究获得国家自然科学基金(5项)、上海市科委、上海市教委项目资助。
相关论文信息
论文原文刊载于Cell Press细胞出版社旗下期刊Cell Reports 上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Pharmacological boosting of cGAS activation sensitizes chemotherapy by enhancing antitumor immunity
▌论文网址:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00286-3
▌DOI:
https://doi.org/10.1016/j.celrep.2023.112275
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




