- +1
中国科学院在对抗肿瘤耐药性方面实现新进展
原创 转网 转化医学网
本文为转化医学网原创,转载请注明出处
作者:Alan
导读:蛋白酶体抑制是首个获得许可的以蛋白酶抑制为目标的治疗策略,并已被证明对血液恶性肿瘤患者有效。
5月20日,中国科学院研究人员在《Nature:Cell Death&Disease》上发表了名为“CD317 maintains proteostasis and cell survival in response to proteasome inhibitors by targeting calnexin for RACK1-mediated autophagic degradation”的文章,研究人员揭示了CD317(一种蛋白酶体)在蛋白质平衡控制中的作用,在临床上将有可能成为解决肿瘤耐药性的靶点。

https://www.nature.com/articles/s4141923-05858-1
研究背景
01
蛋白质占大多数细胞干质量的50%以上,几乎参与每一个生物过程。因此,蛋白质稳态是细胞和机体健康的先决条件。由于不可避免的不利条件(缺氧、葡萄糖剥夺、乳酸酸中毒、氧化应激、氨基酸供应不足等)和内在应激(癌基因激活、染色体数目改变、糖酵解增加等),肿瘤的发生往往与蛋白质平衡网络不平衡有关,也使得癌细胞对靶向蛋白质平衡调节因子的药物敏感。
研究方法
02
蛋白酶体是一种多亚基蛋白酶,可破坏多泛素化蛋白,其中大多数是错误折叠或未组装的多肽,使其成为蛋白质静止的关键调节因子。肿瘤细胞由于其蛋白质组结构的改变,似乎比正常细胞更依赖于蛋白质平衡网络来生存和增殖,这种现象被称为蛋白质平衡成瘾。因此,在正确的剂量下,蛋白酶体抑制剂(PIs)可以杀死癌细胞而保留正常细胞,已被FDA批准用于治疗多发性骨髓瘤和套细胞淋巴瘤。尽管在早期取得了成功,但PIs对实体肿瘤的活性并不高,而且由于耐药性,经常不能治愈血液系统恶性肿瘤。因此需要靶向其他成分或蛋白酶抑制调节因子的药物克服pi的局限性。
CD317,也被称为BST2,是一种II型跨膜糖蛋白。它与多种生理和病理过程有关,包括病毒颗粒系缚、炎症、免疫调节以及肿瘤发生。CD317在多种恶性肿瘤中过表达,激活多个信号轴,促进增殖、迁移、抗药物和免疫细胞溶解等细胞过程。在动物模型中,中和靶向CD317的单克隆抗体、shrna或肽可降低肿瘤生长。此外,CD317与甲型流感病毒感染的宿主细胞中ire1 α介导的内质网应激有关,这表明CD317可能是一种潜在的蛋白质平衡调节剂。然而,目前尚不清楚CD317是否对肿瘤细胞的蛋白酶抑制调节有优势,也不清楚其潜在的分子机制。
研究人员探索了CD317在肿瘤蛋白酶抑制中的作用,CD317在几种血液恶性肿瘤中表达上调,然而其影响是由钙连联蛋白(CNX)介导,钙连联蛋白是一种内质网伴侣蛋白,通过Ca2+泵SERCA抑制钙再填充来负调控内质网Ca2+容量。CD317与CNX相互作用,并使其受到rack1介导的自噬降解,协调内质网腔内Ca2+摄取和蛋白质折叠。这些研究结果表明,CD317在蛋白平衡控制中起着重要作用,可用于提高pi以及其他蛋白平衡靶向药物的治疗效果。
https://www.nature.com/articles/s4141923-05858-1
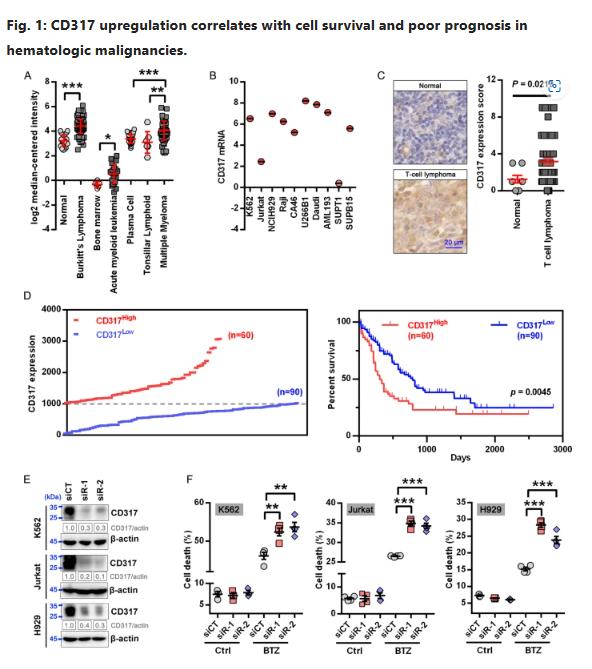
为研究CD317在血液恶性肿瘤(HMs)中的作用,研究人员通过调查公共数据库(Oncomine和CCLE)检测其表达。如图1A所示,在许多HM样本、急性髓性白血病[AML]和多发性骨髓瘤[MM]中,其CD317水平远高于相应的正常样本。一些HM细胞系也被发现含有高水平的CD317(图1B)。此外,通过免疫组化检测,发现CD317蛋白在TCL样本中显著升高(图1C)。使用Oncolnc数据库进行分析,还发现CD317高表达(CD317High)的AML患者比CD317低表达(CD317Low)的患者总生存时间更短(图1D),这表明CD317水平升高会促进肿瘤生长。
为测试CD317在HMs细胞中的功能,使用了三种细胞系。研究人员使用sirna敲除这些细胞中的CD317(图1E)。在正常情况下,CD317敲低对细胞增殖或细胞凋亡没有影响,但在fda批准的蛋白酶体抑制的作用下,会显著增加细胞死亡,这表明低水平CD317的细胞具有脆弱的蛋白质稳态,也证实了CD317 sirna的特异性。这些发现表明,CD317在HMs中表达上调、且在蛋白平衡受到威胁时是细胞存活所必需的物质。
研究意义
03
总之,研究人员揭示了CD317是肿瘤细胞中蛋白质停滞的关键调节因子,这一发现对开发阻止肿瘤生长的治疗蛋白具有重要意义,在临床上将有可能成为解决肿瘤耐药性的靶点。
参考资料:
https://www.nature.com/articles/s4141923-05858-1
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




