- +1
20年首款FDA完全批准的阿尔茨海默病新药疗效如何,礼来恒瑞先声谁能再突围
 “脑海中的橡皮擦”阿尔茨海默病有了新药!
“脑海中的橡皮擦”阿尔茨海默病有了新药!当地时间7月6日,美国食品药品监督管理局(FDA)官网发布消息称,卫材/渤健联合开发的仑卡奈单抗(英文名:lecanemab,英文商品名:Leqembi)用于治疗阿尔茨海默病(AD)的加速批准已成功转为完全批准,该药是20年来首个获得FDA完全批准的阿尔茨海默病药物。
FDA完全批准仑卡奈单抗用于AD治疗
仑卡奈单抗属于β淀粉样蛋白(Aβ)药物,Aβ的生成和清除失衡被普遍认为与阿兹尔海默病进展相关。今年1月,基于IIb期概念验证性临床试验结果,FDA根据加速审评通道认定批准仑卡奈单抗用于AD治疗。
价格上,据美国《时代周刊》等媒体报道,仑卡奈单抗的年治疗费用在2.65万美元,比此前FDA加速批准同为抗Aβ药物的阿杜那单抗便宜了约52%。
在中国,卫材于2022年10月向国家药品监督管理局提交仑卡奈单抗的上市申请。2023年2月28日,卫材中国宣布,该药被国家药品监督管理局纳入优先审评和批准程序,预计将缩短审评时间。对于仑卡奈单抗在国内的进展,7月7日,澎湃新闻记者联系到卫材中国,对方并未透露更多信息,仅表示:“我们也在等待能有进一步的消息。”
首款FDA完全批准的阿尔茨海默病新药疗效如何?
据国际阿尔茨海默病协会(ADI)发布的《世界阿尔茨海默病2018年报告》显示,目前全世界至少有5000万名痴呆患者,到2050年预计将达到1.52亿,其中约60%-70%为阿尔茨海默病患者。
阿尔茨海默病(AD)患者的思维、记忆和独立性会受损,有人形容他们的脑袋里放入了橡皮擦,不仅影响生活质量,甚至导致死亡,FDA更是称之为“毁灭性疾病”。
β淀粉样蛋白( amyloid-β,Aβ) 是目前业内比较认可的阿尔茨海默病的发病机制,此次获批的仑卡奈单抗正是围绕这一机制。

来源:卫材中国微信公众号
早在2021年6月,FDA曾加速批准渤健开发的阿杜那单抗(英文名:aducanumab)用于治疗早期阿尔茨海默病,当时被称为自2003年以来首个获批用于阿尔茨海默病的新型疗法。不过,aducanumab获批后面临的更多的是质疑。
质疑的原因之一是,在FDA批准之前,2020年11月,FDA外部咨询委员会专家一边倒地投票反对批准该药。该药批准后不久,三位FDA周围和中枢神经系统咨询委员会的专家为了表达对该批准的不满,宣布退出咨询委员会。
相比阿杜那单抗,此次获批的仑卡奈单抗此次获批因为有扎实的数据支撑,少了许多争议。6月9日,FDA外周和中枢神经系统药物咨询委员会以6-0投票赞成完全批准仑卡奈单抗的决定。FDA对仑卡奈单抗的完全批准则是基于一项三期临床试验,即301研究,FDA官员评价: “这项验证性研究证实,它对于阿尔茨海默病患者来说是一种安全有效的治疗方法。”
2022年11月,卫材和渤健公布的另一项3期关键临床试验CLARITY 研究数据显示,与安慰剂相比,使用仑卡奈单抗治疗18个月时,临床痴呆症评分总表(CDR-SB)的临床下降27%,此外,由AD看护者评估的次要终点即阿尔茨海默病协作研究组-轻度认知障碍-日常生活能力量表评分(ADCSMCI-ADL)显示出37%的显著统计学获益。
对于27%的数据,有外媒报道称,这是一个温和但具有统计学意义的结果。
年费用2.65万美元,比阿杜那单抗便宜了约52%
对于阿尔茨海默患者和家属而言,新药的出现使其看到了希望,但同时不可忽视的是药品可及性的问题。
价格上,阿杜那单抗的年治疗费用是5.6万美元,渤健方面曾承诺未来四年不会提价。不过,由于该药的疗效争议巨大,采纳利益相关方意见及经同行评议的文件后,医疗保险和医疗补助服务中心(CMS)规定“针对抗Aβ单抗,在FDA加速批准的情况下,CMS仅报销参与FDA或美国国立卫生研究院(NIH)批准的临床试验的Medicare覆盖患者”。
据美国《时代周刊》等媒体报道,仑卡奈单抗的年治疗费用在2.65万美元,比阿杜那单抗便宜了约52%。
价格虽然下降,但这款药可及性依然面临挑战。据《时代周刊》报道,CMS表示,只有在该药物获得FDA的全面批准,且人们注册登记后,才会在研究之外报销该药物。对于CMS要求注册的决定,该报道援引部分专家观点称,可能是出于更实际的目标,即限制首个有效阿尔茨海默病疗法的支出。
对于注册的要求,7月7日,卫材中国发布的新闻稿中表示,很高兴医疗保险将为合适的额患者支付这一重要疗法,这将促进美国更多的医疗机构来报销和使用该药。
在国内,仑卡奈单抗已经被纳入优先审评。7月7日,有阿尔茨海默病患者家属向澎湃新闻记者表示,期待这款药尽快进入中国,但还不知道哪一年会实现。
礼来、恒瑞、先声……谁将继续冲突“医药研发的黑洞”?
阿尔茨海默病的巨大需求吸引了许多药企,但即使是跨国药企巨头也免不了失败,如2012年,辉瑞、强生等宣布停止阿尔茨海默病药物Bapinuezumab的研发;2018年6月,礼来宣布,其和阿斯利康公司正在停止口服β分泌酶裂解酶(BACE)抑制剂Lanabecestat治疗阿尔茨海默病的全球3期临床试验。
屡战屡败,阿尔茨海默症药的研发一度被称为“医药研发的黑洞”。好消息是,近几年,除了上述两款药物,也有药物有了积极进展,走在最前面的是礼来。
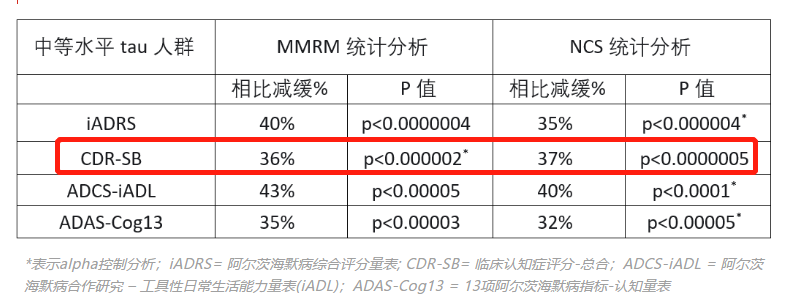
礼来阿尔茨海默病药donanemab的研究数据
今年5月4日,礼来宣布,旗下的阿尔茨海默症药donanemab在TRAILBLAZER-ALZ 2的3期临床研究获得了阳性结果,该试验招募了 1736 名受试者,最终主要终点指标(iADRS)显示donanemab延缓了认知功能下降达35%,且另一个重要的关键次要终点指标(临床痴呆评分, CDR-SB)显示18个月后donanemab延缓下降36% 。这一数据高于卫材/渤健的仑卡奈单抗的27%。
上述试验结果还显示,donanemab近半数 (47%) 的donanemab受试者(安慰剂组为29%)在用药1年后没有出现临床进展。3 期试验达到了主要终点和所有评估认知和功能下降的次要终点。对比安慰剂,donanemab治疗后减缓了患者临床下降达 35%,同时日常生活能力下降的速度减缓了40%。
Donanemab也是抗Aβ单抗,上述数据获得了认可,不过值得注意的是其安全性问题。礼来提到,在这项研究中,严重淀粉样蛋白相关性影像异常(ARIA)的发生率为1.6%,包括两名归因于ARIA而死亡的受试者和另一名在出现严重 ARIA事件后死亡的受试者。
值得关注的是,在中国,礼来Donanemab已进行国际多中心III期临床研究,以评估其治疗早期症状性阿尔茨海默病的安全性和有效性。
司美格鲁肽关于AD的临床研究
有意思的是,今年大火的GLP-1类药物司美格鲁肽也有阿尔茨海默病适应证在研究中。2021年11月,中国药物临床试验登记与信息公示平台最新公示,诺和诺德已在中国启动一项研究口服司美格鲁肽在早期阿尔茨海默病受试者中的疗效和安全性的随机、双盲、安慰剂对照、3期临床试验。诺和诺德和礼来在GLP-1减重领域是竞争激烈的对手。目前该网站依然能查询到上述信息,该试验状态为进行中。
或失败,或成功,阿尔茨海默病相关的研究都没有白走,当下,该领域依然吸引着药企们不断加码。今年4月,武田与生物技术公司Treventis Corporation宣布达成一项合作及许可协议,共同研究、开发和商业化针对阿尔茨海默病(AD)关键蛋白Tau的小分子药物,涉及资金最高可达3.725亿美元。
国内来看,此前已经有绿谷制药的甘露特钠胶囊早已获批用于阿尔茨海默病的治疗,并在2021年底通过医保谈判进入国家医保目录价格降低到296元每盒。但是,这款药时至今日依然面临各种争议。
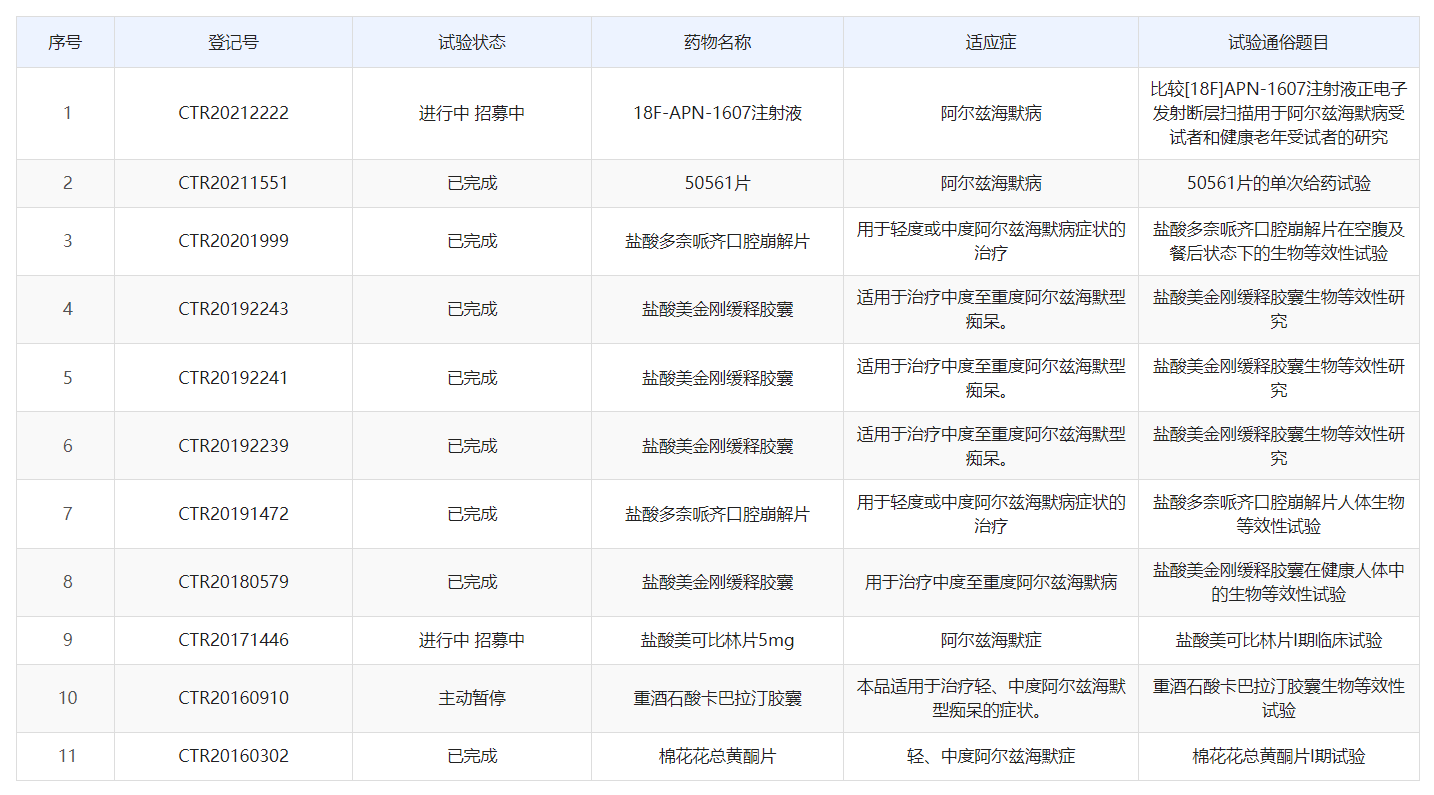
国内部分AD相关的临床试验
从试验来看,澎湃新闻记者在中国药物临床试验登记与信息公示平台能搜索到11项有关阿尔茨海默病的研究,但大多数是盐酸美金刚缓释胶囊、盐酸美可比林片等传统缓解AD症状的药物。
当然,也有企业在积极布局阿尔茨海默的新疗法。今年3月21日,恒瑞医药(600276)宣布,子公司上海恒瑞医药有限公司介绍,公司自主研发的抗Aβ单克隆抗体SHR-1707注射液用于治疗早期阿尔茨海默病的Ib期临床试验在中国科学技术大学附属第一医院完成了首例患者入组及给药。
2022年2月,先声药业(2096)公告称,其在研口服小分子药物SIM0408(PQ912、varoglutamstat)的临床试验申请获药监局批准,用于治疗阿尔茨海默病(AD)导致的轻度认知障碍(MCI)或轻度痴呆。这款口服药是2021年6月先声药业从Vivoryon获取的,这项超5亿美元的合作,让先声药业获得该药在大中华区开发和商业化包括SIM0408在内的2款针对具有神经毒性的淀粉样蛋白N3pE (pGlu-Abeta) 阿尔茨海默病治疗药物的权益。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




