- +1
打造智能CAR-T细胞疗法:克服当前挑战的途径 | Cell Press 青促会述评
原创 Cell Press CellPress细胞科学

生命科学
Life science
作为世界领先的全科学领域学术出版社,细胞出版社特与“中国科学院青年创新促进会”合作开设“青促会述评”专栏,以期增进学术互动,促进国际交流。
2023年第二十七期(总第155期)专栏文章,由中国科学院北京基因组研究所(国家生物信息中心)副研究员、中国科学院青年创新促进会会员和夫红,就Cancer Cell中的论文发表述评。

过继性细胞免疫治疗(adoptive cell immunotherapy,ACT)是一种极有应用前景的革命性癌症治疗新方法,通过人工改造的免疫细胞回输入患者体内实现杀死肿瘤细胞的目的。过继性细胞既能执行传统疗法的肿瘤特异杀伤功能,又可以影响复杂的肿瘤微环境。这类细胞通过肿瘤微环境的变化能够动态地做出反应和决策,不但通过产生稳态和促炎细胞因子来直接杀死癌细胞,而且可以启动一系列连锁反应,调动和协调内源性免疫系统。作为最具代表性的过继性细胞产品,嵌合抗原受体-T 细胞(Chimeric antigen receptor T cell, CAR-T)尽管在多种血液恶性肿瘤中展示出了显著的疗效,但目前没有展现出足够的多功能性来有效根除大多数癌症。这种癌症治疗方法面临着生物学和实践应用方面的诸多挑战,包括治疗耐受性、副作用和毒性反应、个体差异大、生产细胞成本高、适应症局限、长期疗效和持续性监测。这些方面一起导致了CAR-T细胞的应用潜力和实际效果之间的差距。进一步发展 CAR-T 取决于我们如何有效地解决这种新兴治疗范式所需的实践性和生物学要求。尽管有许多创新的技术解决方案可用于使人体免疫细胞更好地对抗癌细胞,但目前尚缺乏有关这些有效途径的系统性概述。
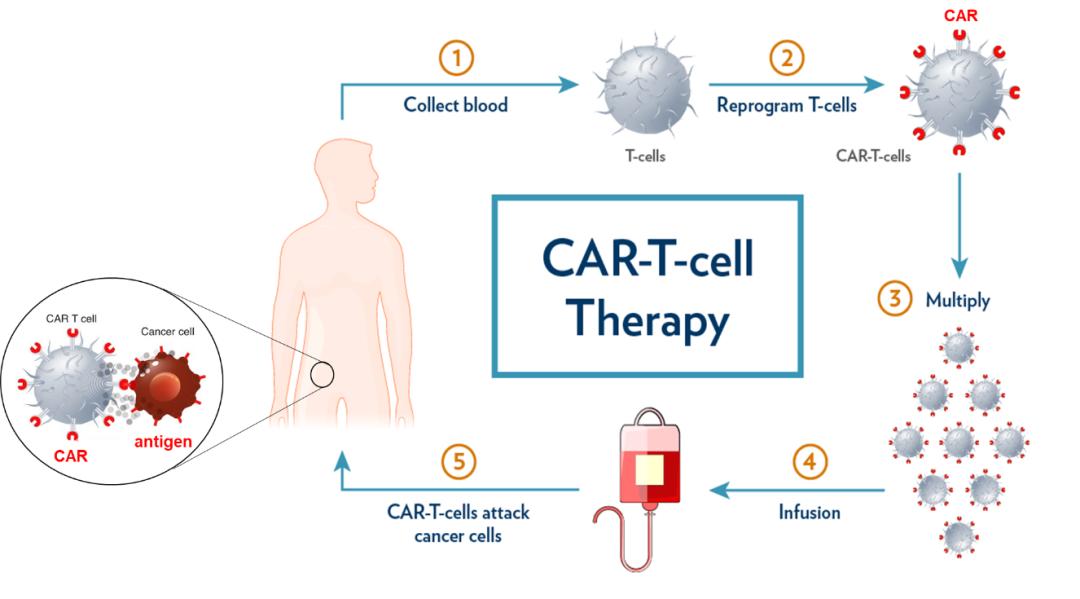
▲图1 CAR-T细胞治疗的流程
图是在美国南卡罗来纳州医科大学(Medical University of South Carolina)网站(Boston Children's Hospital, https://medicine.musc.edu/departments/surgery/news-and-announcements/2021/june/car-t-cell-therapy-research)和波士顿儿童医院网站(https://answers.childrenshospital.org/nanobodies-car-t-cell-therapy/)的基础上改造。
以Cai Q和Marincola FM为主的研究组调研了CAR-T细胞治疗相关基础和临床研究领域的最新进展,总结概述了最能克服这些挑战的潜在途径。针对实践性的要求,作者在总结所有必要的方面基础上,重点介绍了旨在改善 CAR-T 细胞的工艺开发和制造过程的两个过程,一个是自动化简化制造CAR-T细胞产品,另一个是寻找替代细胞类型。针对生物学的要求,作者讨论了改善CAR-T细胞的抗原识别特异性、增加其生物活性和在肿瘤中的持久性以及克服免疫抑制的策略。这些策略包括:(1)优化单个CAR对靶点的结合亲和力和多个CAR对靶点的复合亲和力,实现最佳特异性的肿瘤识别;(2)改变细胞制备过程、细胞工程方法,来延长产品的T记忆干细胞样状态;(3)增强细胞克服不利代谢和免疫抑制条件的能力。作者进一步讨论了实现这些策略的技术解决方案,主要分为四种:(1)通过合成生物学调整抗原识别的特异性、保持其干性和调节肿瘤微环境来改善CAR-T细胞产品;(2)通过依赖场景的适应性精准调节CAR-T细胞的功能,将它们引导到特定的时空坐标;(3)通过多重基因控制,实现在绕过功能失调倾向性的同时提高原始T细胞的治疗能力;(4)开发能够引入大型负载能力携带足够的基因信息的系统,超越当前的信号传递系统限制。最后,作者提出汇集上述各种功能需要跨学术和商业实体的合作,并提出了可能的合作模式。
由于许多有效的过继性细胞治疗所需条件对大多数癌症都是共通的,本文概述的CAR-T细胞相关内容可能会对其他过继性细胞产品和更多类型癌症的治疗产生更广泛的影响。
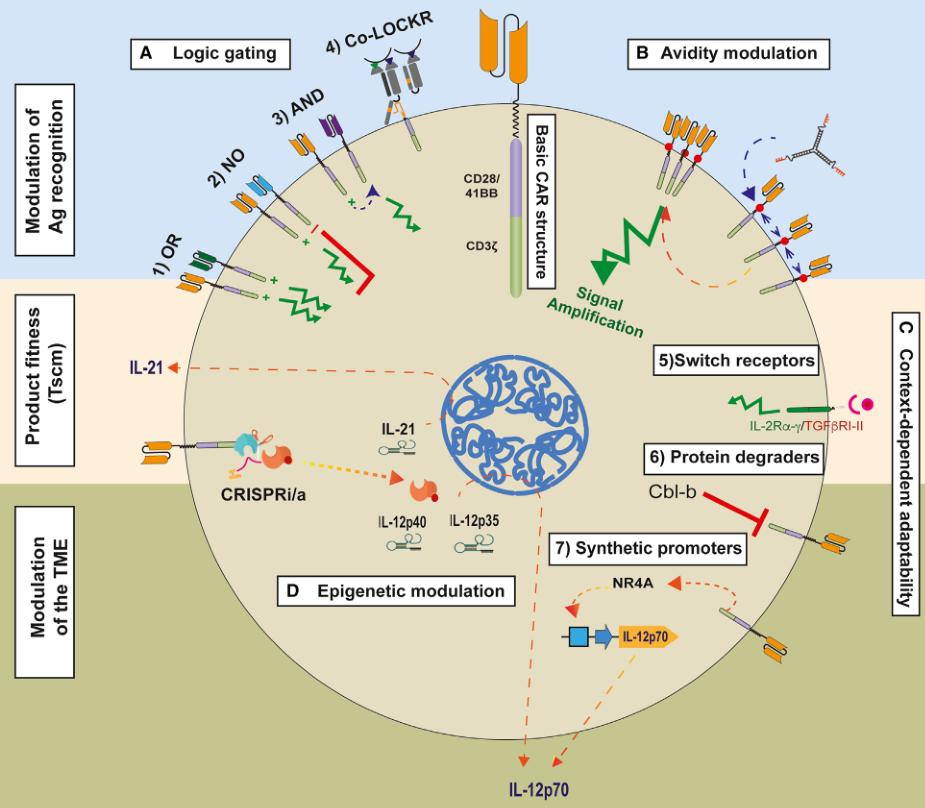
▲图2 通过调节抗原识别和依赖所处场景的适应性来解决癌症的特异性问题,以保持CAR-T细胞产品的健康状态,并通过调整肿瘤微环境来克服免疫抑制。
(A) 逻辑门控制:(1) “OR门”是在癌细胞表达多个目标抗原中的任何一个抗原时均能允许CAR T细胞激活;(2) “NO门”是允许一个CAR的标准抗原依赖性激活的同时,当第二个CAR(抑制性CAR)遇到仅在良性组织中特异性表达的第二个抗原时会干扰其激活;(3) “AND门”是必须通过第一个CAR识别抗原来诱导第二个CAR的表达,只有在这种情况下才能激活;(4) “Co-LOCKR”是可以通过在与相关抗原接触时有条件地发生构象变化,来实现所有以上的这些激活或抑制功能。
(B) 通过可变螺旋线受体(Variable Coiled-Coil Receptor,VCR)调节CAR-T细胞的亲和力(与目标抗原的结合能力)。与多价载体共价结合的小分子靶向CAR的细胞外结构域,通过增强免疫突触来调节亲和力。
(C) 场景依赖的适应性:切换受体使不利因素(如TGF-b)的细胞外结构域与T细胞激活剂(如IL-2 α-γ链)的细胞内结构域结合,将免疫抑制信号转化为免疫刺激信号。蛋白质降解剂通过使用化学化合物降解细胞功能抑制因子(如Cbl-b)来抑制细胞功能抑制因子。合成启动子以具有更高特异性地响应内源或外源信号,超过自然发生的启动子。
(D) 通过CRISPRa/i技术实现的表观遗传调节可以调控内源基因的表达;场景性取决于将CRISPR相关的CAS系统从将其链接到细胞质的适配器中释放出来。释放后,CAS系统迁移到细胞核并根据共表达的sgRNAs定位到所选基因的调控区域。
论文摘要
成功实施癌症的过继性细胞治疗(ACT)需要全面解决生物学和实践性方面的挑战。这种方法在很大程度上被忽视,导致了过继性细胞治疗的应用潜力与其实际效果之间的差距。我们总结了在创建“理想”细胞产品方面最有前景的策略和技术,重点讨论和阐述了嵌合抗原受体(CAR)工程细胞。由于许多有效的ACT所需条件对大多数癌症都是共通的,本文概述的内容可能会产生更广泛的影响。
Successful implementation of adoptive cell therapy (ACT) of cancer requires comprehensively addressing biological and practical challenges. This approach has been largely overlooked, resulting in a gap between the potential of ACT and its actual effectiveness. We summarize the most promising technical strategies in creating an “ideal” ACT product, focusing on chimeric antigen receptor (CAR)-engineered cells. Since many requirements for effective ACT are common to most cancers, what we outline here might have a broader impact.
向下滑动阅览摘要原文
中文内容仅供参考,请以英文原文为准
述评人简介

和夫红
中国科学院北京基因组研究所(国家生物信息中心)副研究员
中国科学院青年创新促进会会员
hefh@big.ac.cn
和夫红,博士,中国科学院北京基因组研究所(国家生物信息中心)王前飞研究组副研究员,中国研究型医院学会血液病精准诊疗专业委员会委员,中国科学院青年创新促进会2015届会员,《Genes》杂志特邀编辑。从事白血病的基因组学、精准医学和肿瘤生物学交叉研究,旨在解决与发病和耐药有关的前沿重要科学问题。发表 SCI 论文 20 多篇,其中共同第一作者论文6 篇,发表在Nature Genetics、Nature Communications、Journal of Clinical Investigation、Genome Biology等学术期刊。成果得到Nature Reviews Cancer、Cancer Discovery等顶级期刊点评,被认为揭示了组蛋白修饰在肿瘤中的重要作用;为难治复发白血病提供了SETD2-H3K36me3通路等多个潜在治疗靶点。
Fuhong He, Ph.D., an Associate Research Professor of CAS Key Laboratory of Genomic and Precision Medicine, Beijing Institute of Genomics, Chinese Academy of Sciences (CAS) and China National Center for Bioinformation, a member of the Precision Diagnosis and Treatment Committee for Hematologic Diseases under the Chinese Research Hospital Association, a member of the Youth Innovation Promotion Association of CAS since 2015, and a guest editor for the scientific journal "Genes". Her research primarily focuses on improving public health by conducting interdisciplinary researches at the intersection of leukemia genomics, precision medicine, and cancer biology. Her overarching goal is to address cutting-edge scientific questions related to leukemia initiation and drug resistance. She has published more than 20 SCI papers including 6 co-first-author papers in prestigious journals such as Nature Genetics, Nature Communications, Journal of Clinical Investigation, Genome Biology, etc. Notably, her work on histone modification in cancer has received acclaim from top-tier journals Nature Reviews Cancer and Cancer Discovery, highlighting the critical role of epigenetic modifications in tumorigenesis. Furthermore, her studies have identified several potential therapeutic targets for refractory and relapsed leukemia, including the SETD2-H3K36me3 pathway.
向下滑动阅览英文简历
相关论文信息
原文刊载于CellPress细胞出版社
旗下期刊 Cancer Cell 上


中国科学院青年创新促进会(Youth Innovation Promotion Association,Chinese Academy of Sciences)于2011年6月成立,是中科院对青年科技人才进行综合培养的创新举措,旨在通过有效组织和支持,团结、凝聚全院的青年科技工作者,拓宽学术视野,促进相互交流和学科交叉,提升科研活动组织能力,培养造就新一代学术技术带头人。
Youth Innovation Promotion Association (YIPA) was founded in 2011 by the Chinese Academy of Science (CAS). It aims to provide support for excellent young scientists by promoting their academic vision and interdisciplinary research. YIPA has currently more than 4000 members from 109 institutions and across multiple disciplines, including Life Sciences, Earth Science, Chemistry& Material, Mathematics & Physics, and Engineering. They are organized in 6 discipline branches and 13 local branches.
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




