- +1
美国发布2023年抗癌报告:一年14种新型抗癌疗法上市
·报告显示,1991年至2020年,美国的癌症死亡率下降33%,这主要得益于人们生活方式的改善和癌症创新疗法的持续开发。2022年10月1日至2023年7月31日,美国食品药品监督管理局(FDA)批准了14种新型抗癌疗法、2种新的光学成像剂上市,并批准了12种老抗癌疗法的新用途。
日前,美国癌症研究协会(AACR)发布《2023年抗癌进展报告》(AACR Cancer Progress Report 2023,以下简称“报告”),回顾了从2022年10月1日到2023年7月31日的重要抗癌进展。
其显示,1991年至2020年,美国的癌症死亡率下降33%,这主要得益于人们生活方式的改善和癌症创新疗法的持续开发。据报告统计,2022年10月1日至2023年7月31日,美国食品药品监督管理局(FDA)批准了14种新型抗癌疗法、2种新的光学成像剂上市,并批准了12种老抗癌疗法的新用途。
尽管如此,癌症仍然是一项持续的全球公共卫生挑战。报告指出,胰腺癌、子宫癌等癌症死亡率一直在上升,人们仍然需要在抗癌的道路上持续努力。
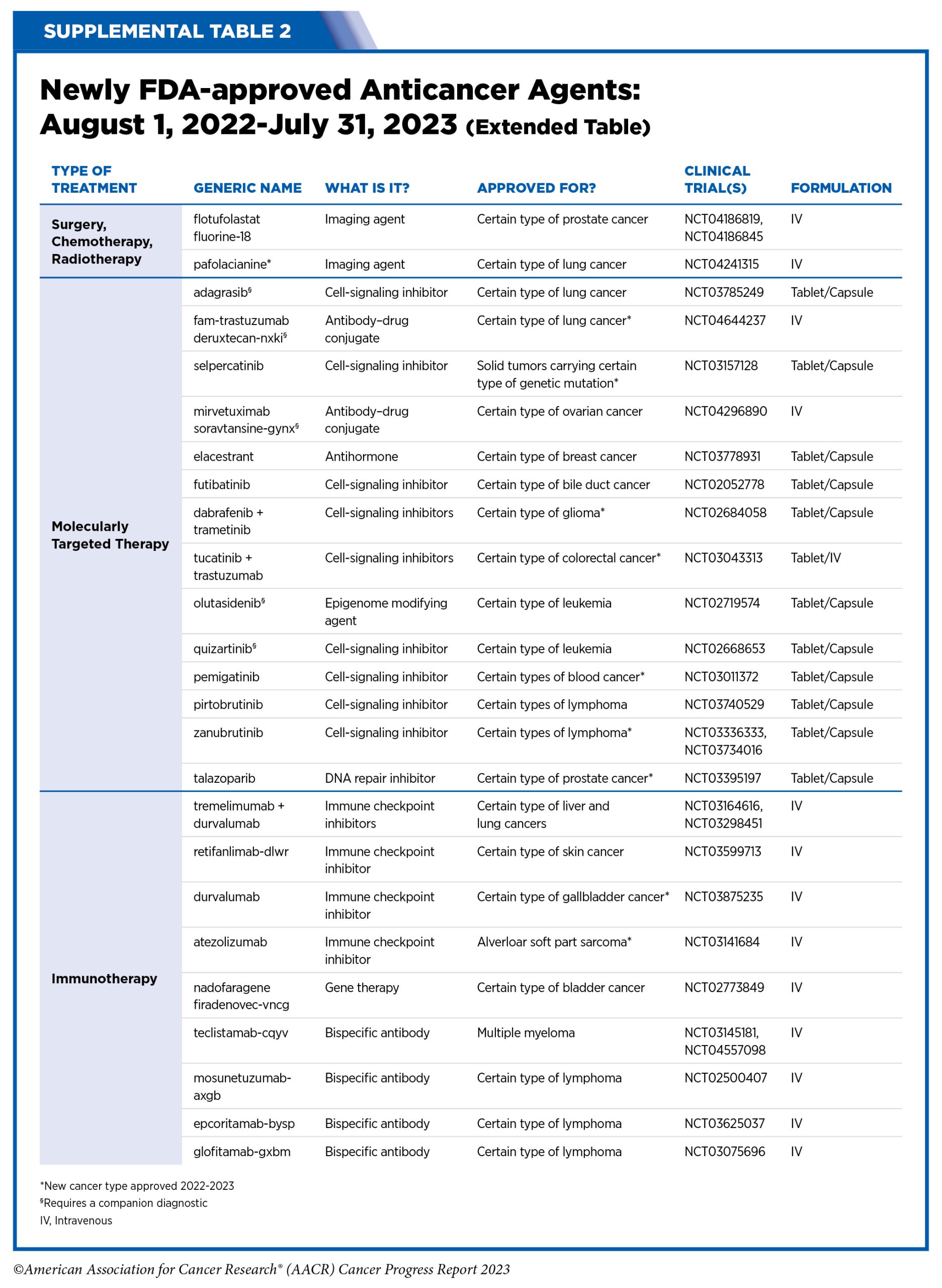
2022年10月1日至2023年7月31日,美国食品药品监督管理局(FDA)批准的新型抗癌疗法。图片来源:《2023年抗癌进展报告》
分子靶向疗法新进展
如今,人们对癌症生物学的理解已经取得了显著的进步,科学家已经鉴定出许多与肿瘤生长相关的基因突变。报告显示,在过去一年获批的14种新型抗癌疗法中,有7种新型抗癌疗法为“分子靶向疗法”,它们针对癌症发展的特定分子,更高的精确度使它们比化疗药物更加有效,且毒性更小。
例如,首个铂耐药卵巢癌抗体-偶联(ADC)药物Mirvetuximab soravtansine-ginx(商品名:Elahere)于2022年11月14日获FDA加速批准,用于叶酸受体α(FRα)阳性、铂耐药上皮性卵巢癌、输卵管癌或原发性腹膜癌的成年患者,他们之前接受过1-3种系统性治疗方案,但效果不佳。Elahere能够通过特异性识别肿瘤细胞表面的靶标蛋白,释放药物分子,进而实现对肿瘤细胞的精确打击,被认为有望打开基于生物标志物的卵巢癌治疗新时代。
一项招募了106名FRα阳性、铂耐药卵巢癌患者的III期临床试验结果显示,Elahere对近32%的患者有效,中位反应持续时间为6.9个月,且有初步证据表明,Elahere可以提高FRα阳性卵巢癌患者群体的总体生存期。
值得一提的是,杭州华东医药股份有限公司(华东医药,000963.SZ)于2020年10月引进了Elahere,交易总金额超过3亿美元,其中包括4000万美元的首付款和2.65亿美元的潜在里程碑付款。华东医药拥有Elahere在大中华区(含中国大陆,香港、澳门和台湾地区)的独家临床开发及商业化权益,其计划于2023年下半年向中国国家药品监督管理局(NMPA)递交生物药上市许可申请(BLA)。
免疫疗法腾飞
“过去十年,癌症免疫疗法已经成为最令人兴奋的癌症疗法之一。”报告写道。癌症免疫疗法通过激活免疫系统来治疗癌症,不同的免疫疗法可以通过不同的方式释放免疫系统能力来对抗癌症。
免疫检查点抑制剂(ICIs)通过释放免疫系统的天然抗癌能力来发挥作用,它们可以释放T细胞的“刹车”,并激活T细胞破坏癌症细胞。报告称,免疫检查点抑制剂已经彻底改变了癌症治疗的格局。
报告显示,过去一年,FDA批准了2种新的免疫检查点抑制剂:Tremelimumab (商品名:Imjudo) 和 Retifanlimab-dlwr(商品名:Zynyz)。
Imjudo被批准与另一种免疫检查点抑制剂Durvalumab(商品名:Imfinzi)联合使用,以治疗不可切除的肝细胞癌(HCC)成年患者。一项针对既往未接受过全身治疗的不可切除HCC患者的随机III期临床试验将Imjudo与Imfinzi联合使用的疗效与标准护理进行了比较,试验结果表明,接受免疫检查点抑制剂组合的患者在研究过程中死亡的风险降低了22%。
2023年2月,FDA批准Zynyz用于治疗转移性或复发性局部晚期默克尔细胞癌的成年患者,这是一种罕见的侵袭性皮肤癌。Zynyz是一种靶向程序性死亡受体-1(PD-1)的人源化单克隆抗体,它通过与PD-1受体结合,提高免疫细胞发现和杀伤肿瘤细胞的能力。该批准是基于以下发现:作为II期临床研究的一部分,接受Zynyz治疗的患者中,超过一半的患者的肿瘤缩小。
T细胞结合双特异性抗体是另一种免疫疗法,能同时与靶细胞上的肿瘤相关抗原和T细胞上TCR复合体的CD3亚单位结合。据报告,过去一年,美国FDA批准了4款新的T细胞结合双特异性抗体疗法。
2022年10月,FDA批准Teclistamab cqyv(商品名:Tecvayli)用于多发性骨髓瘤的成年患者,这些患者在至少接受过4种治疗后复发或从未反应。Tecvayli能够靶向结合T细胞表面表达的CD3受体以及多发性骨髓瘤细胞(MM)和一些健康B细胞表面表达的B细胞成熟抗原(BCMA),将CD3阳性T细胞重新定向到表达BCMA的MM细胞,以诱导针对靶细胞的细胞毒作用。一项I/II期临床试验评估了110名患者的免疫治疗效果,结果显示Tecvayli对超过60%的患者有效。
另外三种获批的T细胞结合双特异性抗体疗法为Mosunetuzumab-axgb (Lunsumio),Epcoritamab-bysp(Epkinly),和Glofitamab-gxbm (Columvi),都通过附着在T细胞上的CD3和CD20发挥作用。
嵌合抗原T细胞(CAR-T)疗法在癌症治疗中是绕不开的话题,近年来,它在癌症医学中引起了巨大轰动。CAR-T疗法旨在急剧增加患者具有的癌症杀伤T细胞的数量,从而增强免疫系统寻找和破坏癌细胞的能力。据报告介绍,截至2023年7月31日,FDA已批准6种截然不同的CAR-T细胞疗法,用于治疗一系列血液系统癌症(全球总计有8款CAR-T疗法获批)。
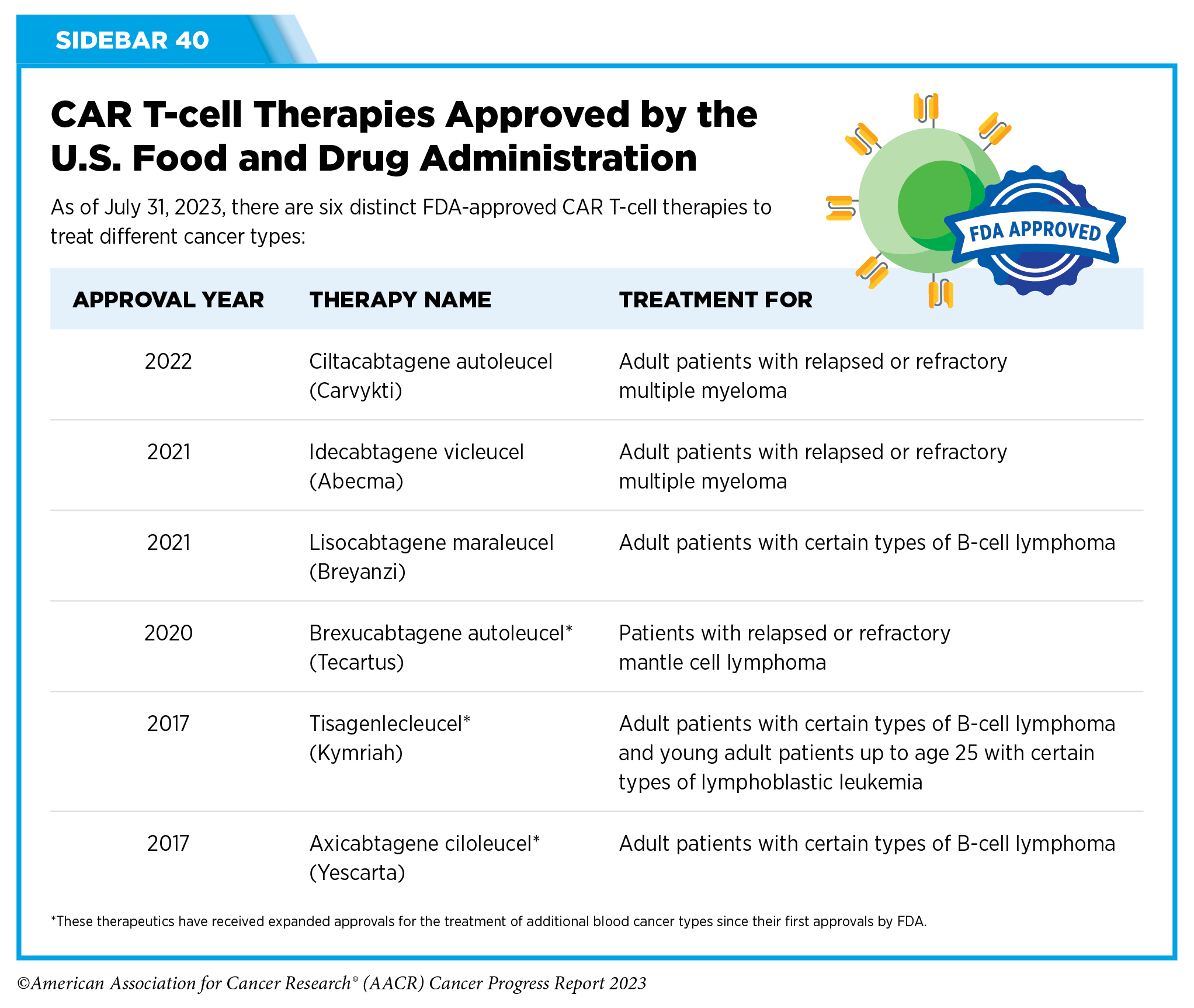
美国食品药品监督管理局(FDA)批准的CAR-T疗法。图片来源:《2023年抗癌进展报告》
呼吁增加投资和提高临床试验参与率
除上述进展外,全球还有许多不同类型创新癌症疗法的临床试验正在进行中。报告显示,截至2022年4月5日,全球共有2756项细胞疗法临床试验正在进行中,其中包括568款CAR-T疗法、73款CAR-NK细胞疗法等,靶向CD19、BCMA、TAA和HER2等不同类型靶点。
尽管癌症治疗已经取得了重大进展,但报告强调,目前存在两个迫切需要克服的挑战:癌症临床试验的参与率低,以及参与者缺乏社会人口多样性。少数种族和族裔以及其他医疗服务不足地区的人群承担着与其人数不成比例的癌症负担,但来自这些人群的患者参与新型抗癌疗法临床试验的比例低得令人失望。因此必须采用新的方法来告知、教育和鼓励这些癌症患者参加临床试验,以便研究人员能够确定最有效的方法来帮助所有患者。
报告认为,癌症研究的一个前沿领域是开发针对顽固性癌症的疗法,如胰腺癌和胶质母细胞瘤。报告特别关注人类肠道微生物组在调节对癌症治疗的反应方面的贡献,以及人类肠道微生物组可能有助于降低患癌症风险的发现,其认为,这些发现有可能彻底改变未来的癌症治疗和护理。
癌症科学和医学的新前沿。图片来源:《2023年抗癌进展报告》
AACR呼吁增加对癌症研究的投资。“降低癌症的死亡率需要癌症研究人员、政府和癌症社区承诺投资癌症研究,并增加癌症患者对临床试验的参与。”AACR主席菲利普·格林伯格(Philip D. Greenberg)说道。
癌症的预防同样重要。据报告估计,美国40%的癌症病例是可以预防的,预防的方式包括减少使用烟草、避免不健康的饮食、增加身体活动、降低紫外线辐射暴露,限制饮酒和预防致病性感染等。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




