- +1
一致性评价意见稿重申三年淘汰制,对千亿仿制药市场影响有多大
 千亿仿制药格局或迎来新一轮洗牌。
千亿仿制药格局或迎来新一轮洗牌。9月25日,国家药品监督管理局药品审评中心(CDE)发布《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》(简称“意见稿”),公示期自公示之日起一个月。至10月25日,意见稿公示期已经结束。
公示期间,上述意见稿的部分信息引发行业讨论,如“自第一家品种通过一致性评价后,三年后不再受理其他药品生产企业相同品种的一致性评价申请”。不少业内人士指出,此次征求意见稿是对更早之前一致性评价相关文件的延续和细化。
也有专家向澎湃新闻记者表示,对于行业而言,征求意见稿针对新注册管理办法之前获批的存量仿制药将起到劝退作用,现有的仿制药批文或将迎来新一轮洗牌。长期来看有利于形成产业良性循环,促进中国仿制药行业的发展。
仿制药一致性评价是什么?有何价值?
近几年,创新是医药行业的关键词,创新药也是整个行业讨论的焦点,但事实上,与原研药相对的仿制药同样对于行业和患者有巨大的价值。
中国医药工业信息中心编著的《中国仿制药发展报告》(2022版)提到,2021年,中国仿制药市场规模约为 9069亿元。国家药监局官网2022年5月发布的药监政策速览(第35期)提到,我国现代制药业起步较晚,药品生产以仿制为主。已批准上市的化学药中,95%以上为仿制药,涵盖心脑血管系统、呼吸系统、抗肿瘤、抗感染等近30个治疗领域,基本满足公众临床用药需求。
中国药科大学国际医药商学院教授路云向澎湃新闻记者表示,对中国医药行业而言,创新药的持续更新,为仿制药带来生机,而仿制药的上市与出现,直接打破了原研药原有的市场垄断地位,使市场竞争更加充分,激发了创新药企业的创新动力,推动了中国整个医药行业的创新发展。
中国医药创新促进会执行会长宋瑞霖在近期一场活动上提到,改革开放后,拉动地方经济与规范产业发展之间存在巨大争论。药品标准低、药品监管水平低,药品生产经营盲目发展,医药市场比较混乱,而不是以临床需求为目标,这也是后来推行仿制药一致性评价的根源。

《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》
我国仿制药一致性评价工作在2012年启动,2016年3月,国务院办公厅发布的“289目录”则被行业认为是一致性评价工作全面开启。“289目录”是当时国务院发布《关于开展仿制药质量和疗效一致性评价的意见》明确,《国家基本药物目录(2012年版)》中2007年10月1日前批准上市的化学药品仿制药口服固体制剂应在2018年底前完成一致性评价,共涉及289个品种,因此被称为“289目录”。
一致性评价面向已批准上市的仿制药,按照与原研药质量和疗效一致的原则进行。一般来说,企业开展一致性评价的流程是企业首先确定参比制剂,并根据药品的特性对参比制剂和仿制药分别开展体外对比研究和生物等效性研究,部分药品在满足一定条件的情况下可豁免生物等效性研究。根据对比结果,在对比研究一致的情况下可向药监局申报资料并等待评审结果公布。
路云介绍,过去近十年,政府不断出台法规文件和指南,进一步指导一致性评价工作,细化评价方法、参比制剂、临床试验等方面内容。目前,一致性评价体系逐渐成熟、完善,工作成效显著。随着我国仿制药一致性评价的持续推进,极大提高了药品的安全性和有效性,同时极大降低了药品价格。
米内网数据显示,截至2023年9月30日,通过一致性评价(含视同通过)的受理号达到7516个,涉及药品1088个。其中,一致性评价受理号达到3620个,涉及品种656个;新注册分类仿制药受理号(视同通过一致性评价)达到3896个,涉及品种734个。过评超过100个品种的企业包括齐鲁制药、科伦药业、扬子江药业、正大制药、石药控股、成都倍特、复星医药、上海医药、华润医药等企业。
从近五年过评的受理号情况来看,2020年起每年均超过1000个,2021年暂为峰值,超过2000个。从趋势来看,按新分类视同过评的受理号越来越多,2022年的占比已超过53%。
一致性评价花费可达百万,意见稿或加速仿制药批文洗牌
一致性评价是国家药品集采和部分省市集采的前提条件,因此上述过评排名居前的企业,也是集采中标大户,例如米内网数据显示,从最早的4+7试点到第七批集采,扬子江药业总中标产品数量已达42个。
开展一款药的仿制药的一致性评价,需要企业投入费用和时间。澎湃新闻记者梳理多家上市公司产品通过一致性评价的公告发现,费用大都在百万级别。
10月23日,白云山(600332)公告称,控股子公司广州白云山天心制药股份有限公司的注射用头孢呋辛钠(0.5g)已通过一致性评价。该药于1994年上市,于2023年2月23日递交一致性评价申请,于2023年3月8日获得受理。白云山在公告中提到,截至公告日,天心药业在该药一致性评价的研发项目上已投入研发费用约217万元(未审计)。
10月11日,国药现代(600420)曾公告称,控股子公司国药集团致君(深圳)制药有限公司的注射用头孢唑林钠(1.0g)通过一致性评价。截至目前,国药致君用于开展该药一致性评价累计研发投入约330万元 (未经审计)。
9月25日,上海医药(601607)曾公告,全资子公司上海上药信谊药厂有限公司的双氯芬酸钠缓释片通过一致性评价。截至公告日,公司针对该药品的一致性评价已投入研发费用约899.45万元。
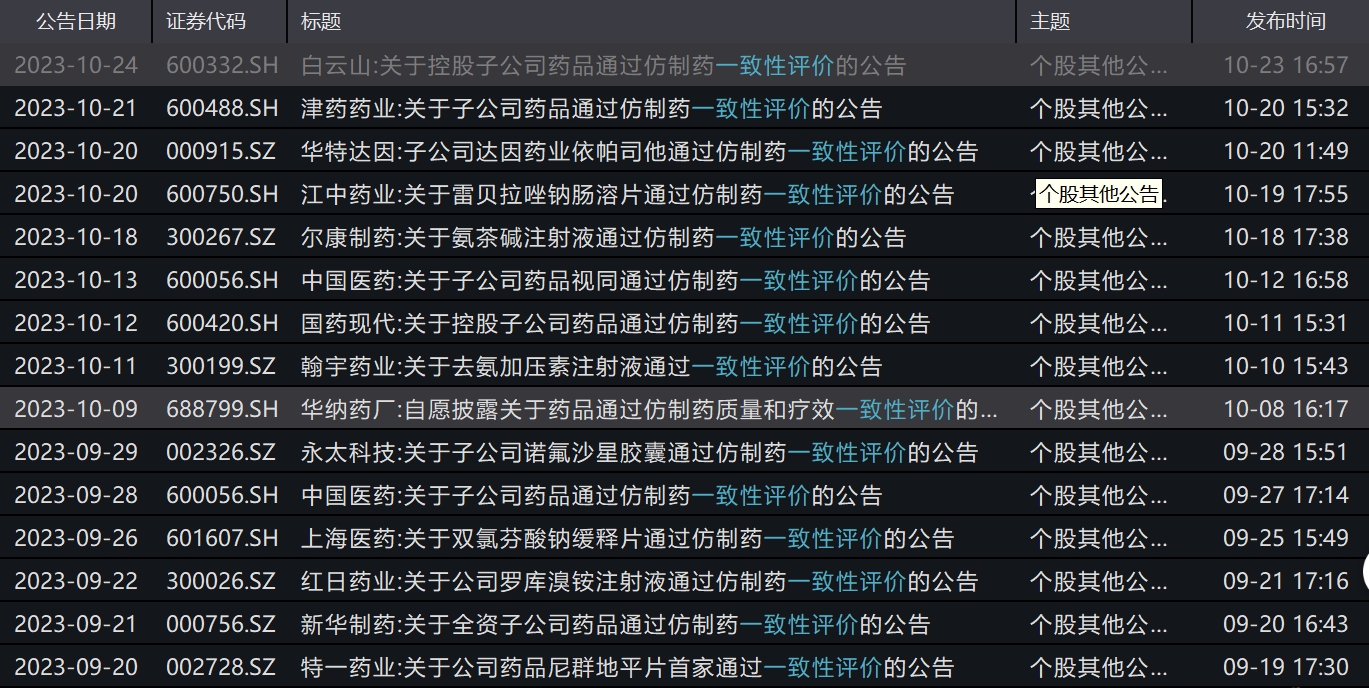
A股上市公司近期关于一致性评价的部分公告
路云向澎湃新闻记者介绍:“开展一致性评价的费用包括了参比制剂购买费用、体外对比研究费用、生物等效性研究费用以及原辅料支出等,因此不同的药品开展一致性评价的费用存在差异,但对于中小企业来讲,开展一致性评价的费用整体均较为昂贵。此外,企业从立项到完成体外对比研究和生物等效性研究所花费的时间也存在差异。”
“整体来看,所花费的时间不会超过3年,在3年的期限内,企业有充足的时间开展一致性评价。”路云认为,此次征求意见稿中三年的时间不会影响企业开展一致性评价,而且意见稿还充分保障了临床必需、市场短缺品种的权益,规定“企业经评估认为属于临床必需、市场短缺品种的,可向所在地省级药品监管部门提出延期评价申请”,进一步提升了我国仿制药质量和制药行业的整体发展水平,保证了公众用药的安全有效。
上述此次征求意见稿的影响,路云认为,对于行业而言,意见稿针对新注册管理办法之前获批的存量仿制药将起到劝退作用,能够有效避免重复、无效创新。基于此,大批量仿制药批文“退市潮”将再次掀起,未通过一致性评价的存量仿制药将面临退市风险,长期来看,这将形成产业良性循环,进一步推动药品质量优化。
多家券商持有类似的观点。浙商证券研报指出,此政策是针对已上市存量品种一致性评价的延续性政策,有企业获批一致性评价的品种对应的逾期未完成一致性评价的批文将迎来洗牌;太平洋证券研报指出,本次发布的征求意见稿相当于对政策的重申及落实执行,政策端清退同质化扎堆的仿制药。采购端和产品端的双重出清,未来仿制药行业集中度将进一步提升。
未来一致性评价将扩大至所有剂型
从2012年来算,仿制药一致性评价在国内已经推行了11年。这项工作在取得成就的同时也面临着不多待解问题。宋瑞霖指出,到今天一致性评价也没做完,也只能一边做一边去解决。路云则向澎湃新闻记者介绍,一致性评价依然存在各地区政策推进进展不一,个别品种参比制剂难以获得的情形。
例如,截至2021年6月底,江苏省便已有188个品种规格通过一致性评价,但江西省截至2023年3月底,仅62个批准文号通过一致性评价(含视同过评),仅占全国1.2%。此外,江西省已公布参比制剂的批准文号为398个,仅覆盖江西省仿制药批准文号的18.6%,目前依然存在诸多仿制药暂无参比制剂的情形。
针对上述问题,路云向记者介绍,部分省份对未过评仿制药进行挂网资格和价格管理。例如江苏、陕西、上海等21个省份规定“过评企业≥3家时,未过评药品将不予挂网/暂停采购”;山西、河北等6个省份通过区分药品质量层次,将挂网药品分为过评仿制药和未过评仿制药,设定不同的倍数限制以保持合理的价格分布与比价关系,进而鼓励企业积极过评,推动化学药品一致性评价进程。
来源:《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》
值得一提的是,本次《征求意见稿》提出了口服固体制剂和注射剂以外其它剂型申报资料的要求。路云认为,这意味着所有剂型未来都可以启动一致性评价,拓宽集采品种范围。进而协同国家组织药品集中带量采购政策,在保证仿制药质量和供应的前提下,助力加快实现质优价廉的仿制药临床替代,进一步优化我国医药产业,促进我国由仿制药大国向强国的跨越。
浙商证券研报还指出,国内待开发仿制药品种依然较多,以MAH(药品上市许可持有人)客户为主的新势力带来的研发、生产外包需求较大,由此带来的仿制药新品种研发投入是相对稳定且持续的,为仿制药医药外包(CXO)公司带来了后集采、后一致性评价时代下的新增长窗口。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




