- +1
【前沿进展】Cell Reports丨钟清/留筱厦合作阐明自噬体和溶酶体融合中SNARE蛋白复合体…
自噬对于细胞降解和回收细胞组分至关重要。在这一过程中,自噬体和溶酶体之间的融合介导了自噬底物的降解。以往研究发现,在哺乳动物细胞中该过程由两套SNARE蛋白复合体 STX17-SNAP29-VAMP8 和 STX7-SNAP29-YKT6 共同驱动。然而,两套SNARE蛋白复合体之间的相互作用及其意义仍有待揭示。
近日,上海交通大学医学院病理生理学系钟清、留筱厦课题组在Cell Reports发表了题为 Human YKT6 forms priming complex with STX17 and SNAP29 to facilitate autophagosome-lysosome fusion 的研究论文。研究者运用体外搭建的模拟自噬体与溶酶体融合的生化体系结合超高分辨成像技术以及蛋白亲和纯化等技术,挑战了STX17-SNAP29-VAMP8 和 STX7-SNAP29-YKT6在自噬体-溶酶体融合中独立发挥作用的观点。研究发现,YKT6 能够优先通过其 SNARE 结构域与自噬体上的 STX17 和 SNAP29 形成复合体,该复合体具有促进 STX17-SNAP29-VAMP8 驱动的自噬体-溶酶体融合过程的功能。
 首先,为了探究两套SNARE蛋白复合体之间的关系,研究者构建了STX17 KO的细胞系并运用siRNA短暂抑制YKT6的表达。自噬流,TEM等实验结果都显示STX17和YKT6都参与自噬体-溶酶体融合过程。然而有趣的是,当运用siRNA短暂抑制STX7的表达来阻断STX7-SNAP29-YKT6驱动的自噬体-溶酶体融合过程后,再运用siRNA短暂敲除YKT6,自噬流相较于单敲STX7被进一步抑制了,这一现象提示YKT6存在独立于STX7-SNAP29-YKT6复合体促进自噬体-溶酶体融合的功能。
首先,为了探究两套SNARE蛋白复合体之间的关系,研究者构建了STX17 KO的细胞系并运用siRNA短暂抑制YKT6的表达。自噬流,TEM等实验结果都显示STX17和YKT6都参与自噬体-溶酶体融合过程。然而有趣的是,当运用siRNA短暂抑制STX7的表达来阻断STX7-SNAP29-YKT6驱动的自噬体-溶酶体融合过程后,再运用siRNA短暂敲除YKT6,自噬流相较于单敲STX7被进一步抑制了,这一现象提示YKT6存在独立于STX7-SNAP29-YKT6复合体促进自噬体-溶酶体融合的功能。通过免疫共沉淀实验,研究者发现过表达STX17的同时过表达YKT6,两者非但没有相互竞争SNAP29形成相对应的两套SNARE蛋白复合体 STX17-SNAP29-VAMP8 和 STX7-SNAP29-YKT6,反而互相促进了STX17和YKT6与SNAP29的结合。据此,研究者推测YKT6与STX17和SNAP29之间可能存在相互作用。
随后,利用IP实验,pull down实验,SNARE蛋白体外组装实验,以及超高分辨成像等技术,研究者阐明确实存在YKT6-SNAP29-STX17这一复合体,并且多种诱导自噬的条件均可促进该复合物的组装。进一步的,研究者证明该复合体组装依赖于YKT6的SNARE结构域,且YKT6的RQ突变体能够降低该复合体的组装效率。
最后,研究者通过体外膜融合生化体系探究了YKT6-SNAP29-STX17这一复合体在自噬体-溶酶体融合中的功能。研究者发现YKT6-SNAP29-STX17在自噬体膜上的预组装能够有效促进后续STX17-SNAP29-VAMP8驱动的自噬体-溶酶体融合过程,且YKT6的RQ突变体不具有此功能。据此,研究者认为在哺乳动物细胞自噬过程中,YKT6-SNAP29-STX17复合物可能行使priming complex的功能,其可能促进并稳定具有融合活性的STX17-SNAP29-VAMP8复合物的形成,以促进自噬体-溶酶体融合。
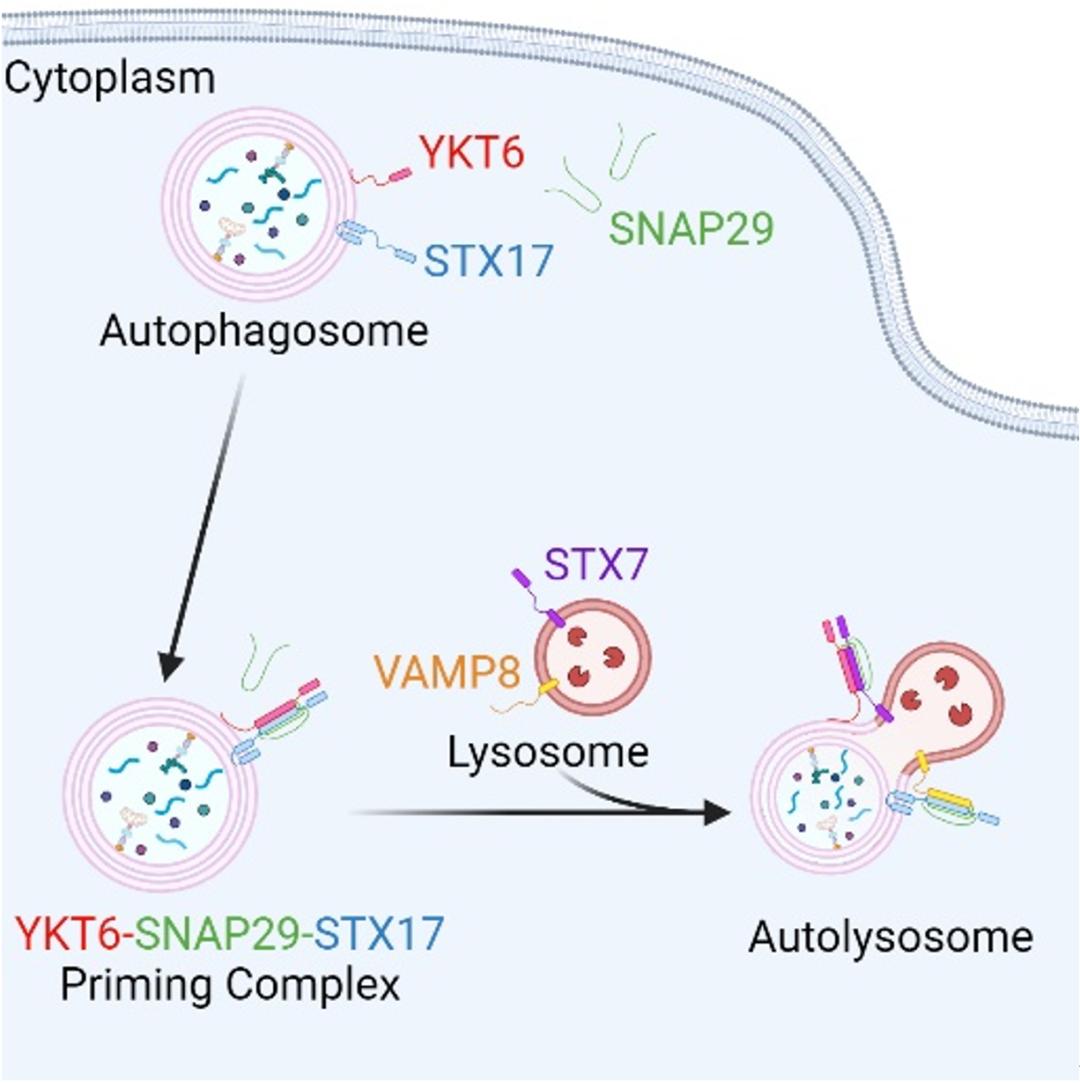 综上,该研究发现了哺乳动物细胞自噬过程中YKT6-SNAP29-STX17这一复合体作为priming complex能够有效促进后续STX17-SNAP29-VAMP8 驱动的自噬体-溶酶体融合过程,为自噬过程中多个SNARE蛋白复合体的协同作用和复杂调节提供了有价值的见解。
综上,该研究发现了哺乳动物细胞自噬过程中YKT6-SNAP29-STX17这一复合体作为priming complex能够有效促进后续STX17-SNAP29-VAMP8 驱动的自噬体-溶酶体融合过程,为自噬过程中多个SNARE蛋白复合体的协同作用和复杂调节提供了有价值的见解。上海交通大学医学院博士生郑邓昊,博士后童敏丹博士为该论文的共同第一作者,上海交通大学医学院留筱厦副研究员和钟清研究员为该论文的共同通讯作者。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00088-3#%20
参考文献
1.Itakura E, Kishi-Itakura C, Mizushima N. The hairpin-type tail-anchored SNARE syntaxin 17 targets to autophagosomes for fusion with endosomes/lysosomes. Cell. 2012 Dec 7;151(6):1256-69. doi: 10.1016/j.cell.2012.11.001. PMID: 23217709.
2. Matsui T, Jiang P, Nakano S, Sakamaki Y, Yamamoto H, Mizushima N. Autophagosomal YKT6 is required for fusion with lysosomes independently of syntaxin 17. J Cell Biol. 2018 Aug 6;217(8):2633-2645. doi: 10.1083/jcb.201712058. Epub 2018 May 22. PMID: 29789439; PMCID: PMC6080929.
3.Gao J, Reggiori F, Ungermann C. A novel in vitro assay reveals SNARE topology and the role of Ykt6 in autophagosome fusion with vacuoles. J Cell Biol. 2018 Oct 1;217(10):3670-3682. doi: 10.1083/jcb.201804039. Epub 2018 Aug 10. PMID: 30097515; PMCID: PMC6168247.
4.Bas L, Papinski D, Licheva M, Torggler R, Rohringer S, Schuschnig M, Kraft C. Reconstitution reveals Ykt6 as the autophagosomal SNARE in autophagosome-vacuole fusion. J Cell Biol. 2018 Oct 1;217(10):3656-3669. doi: 10.1083/jcb.201804028. Epub 2018 Aug 10. PMID: 30097514; PMCID: PMC6168255.
5.Takáts S, Glatz G, Szenci G, Boda A, Horváth GV, Hegedűs K, Kovács AL, Juhász G. Non-canonical role of the SNARE protein Ykt6 in autophagosome-lysosome fusion. PLoS Genet. 2018 Apr 25;14(4):e1007359. doi: 10.1371/journal.pgen.1007359. PMID: 29694367; PMCID: PMC5937789.
6. Yong CQY, Tang BL. Another longin SNARE for autophagosome-lysosome fusion-how does Ykt6 work? Autophagy. 2019 Feb;15(2):352-357. doi: 10.1080/15548627.2018.1532261. Epub 2018 Oct 13. PMID: 30290706; PMCID: PMC6333455.
原标题:《【前沿进展】Cell Reports丨钟清/留筱厦合作阐明自噬体和溶酶体融合中SNARE蛋白复合体的相互调控关系》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




