- +1
李汉杰/王冠琳团队丨人体巨噬细胞研究新进展及研究策略
原创 Cell Press CellPress细胞科学

生命科学
Life science
巨噬细胞是免疫系统的重要组成成分, 在识别吞噬病原体、抵抗感染、器官生成、组织重塑、代谢适应、疾病发生发展中发挥重要作用。近日,中国科学院深圳先进技术研究院的李汉杰与复旦大学代谢与整合生物学研究院的王冠琳团队在Cell Press细胞出版社旗下期刊Trends in Immunology发表了题为 “Approaches for studying human macrophages”的观点文章,系统回顾了近年人体巨噬细胞多样性、发育和功能的最新研究进展,提出了综合单细胞转录组学、空间转录组学、类器官共培养系统和基于人工智能的计算工具等方法研究人体组织驻留巨噬细胞的组合策略,从而更好的理解组织驻留巨噬细胞的起源、发育、功能,为巨噬细胞相关疾病(包括癌症、自身免疫性疾病和衰老相关疾病)的治疗提供新思路。
有兴趣在Trends in Immunology发表您的综述文章?请扫描提交论文提案 (presubmission inquiry)。
1. 人体巨噬细胞研究的新方法
巨噬细胞的功能与其所驻留的组织相适应、受到所处微环境的影响。小鼠等啮齿类动物模型是研究组织驻留巨噬细胞起源、分化、多样性、功能的强有力工具。在过去的二十年里,研究人员在小鼠巨噬细胞的研究中取得了显著进展,而对人体巨噬细胞的了解仍处于前期。由于小鼠与人在解剖结构、组织功能复杂性、先天与适应性免疫系统发育激活等方面存在显著差异,进一步研究人体巨噬细胞的特征和发育至关重要,有助于开发靶向巨噬细胞治疗人体疾病的新方法。
尽管人体巨噬细胞研究面临许多挑战,如样品的可及性、功能检测的可能性、遗传修饰的复杂性、遗传异质性等。单细胞转录组学、空间转录组学、类器官共培养系统和基于人工智能的计算工具等技术和分析手段的进步,为研究人体巨噬细胞提供了前所未有的机会,巨噬细胞在人体组织中的多样性、发育起源、微环境和功能被逐渐揭开。
2. 绘制人体巨噬细胞的时空多样性
对不同发育阶段的各器官组织进行单细胞测序分析有助于对全面描述人体巨噬细胞的多样性(图1A)。前期研究发现来自不同器官的巨噬细胞的转录组相似高。例如,两个研究组各自独立发现,位于中枢神经系统(CNS)外的类小胶质细胞与CNS中的传统小胶质细胞拥有相似的转录组,这挑战了小胶质细胞仅在CNS中分化的传统观念。考虑到组织驻留巨噬细胞的表型受其发育历程和组织微环境的影响,来源于同一祖细胞群的不同组织器官中的驻留巨噬细胞,可能会展现出相似的转录组。长期以来,组织内巨噬细胞的分类与命名主要是基于它们所处的位置。基于最新的单细胞转录组结果,有必要重新考虑这种分类方法。基于巨噬细胞的祖细胞来源和分子表型进行分类,可能能够更准确地描述它们的多样性和功能。
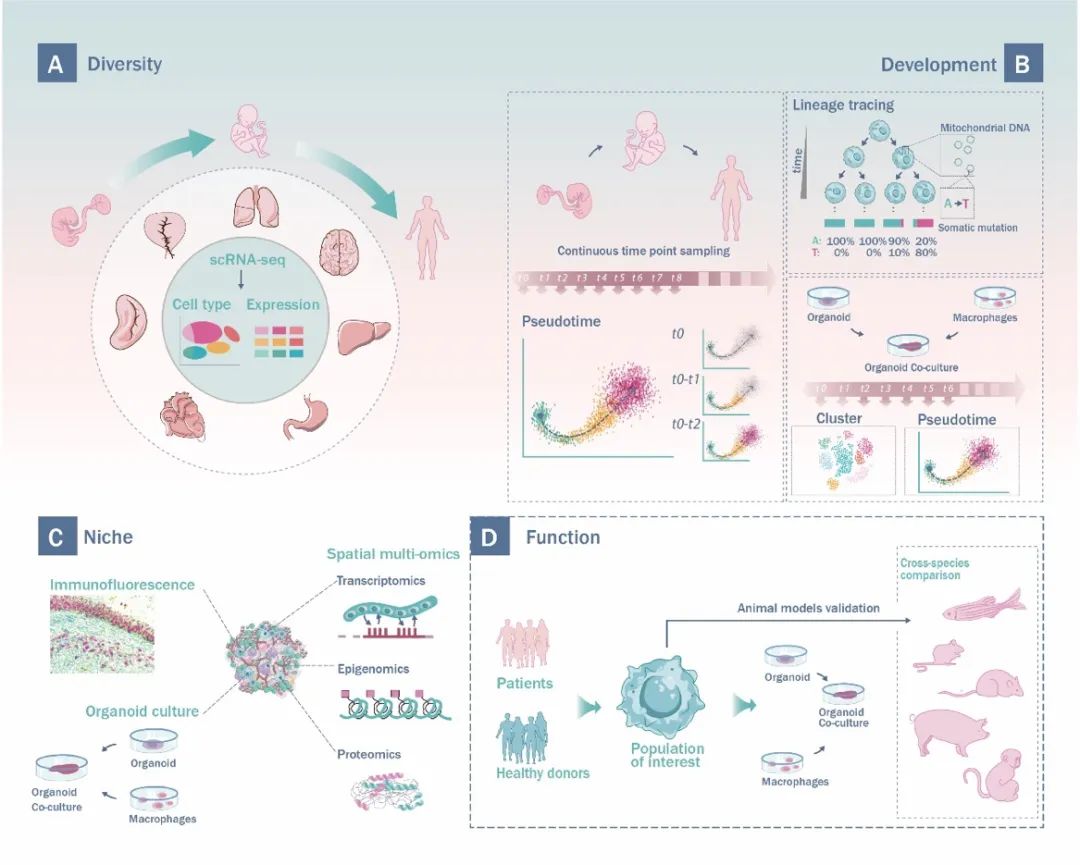
▲图1 | 人体巨噬细胞研究策略组合。
3. 人体巨噬细胞的发育起源和谱系追踪
高时空分辨率的单细胞组学数据有助于描绘巨噬细胞的发育轨迹。前期基于多个时间点和多个组织的单细胞转录组研究表明,小胶质细胞和血管周围巨噬细胞呈现出平行的分化过程,但其他组织驻留巨噬细胞的发育起源还需要进一步探索。除了单细胞多组学技术,综合多种谱系追踪方法,包括基于时间尺度的类器官平台、基于机器学习的计算方法、线粒体突变条形码策略等,有助于更好的理解巨噬细胞的时空发育过程(图1B)。
4. 组织驻留巨噬细胞与其微环境的相互作用
组织微环境调控组织驻留巨噬细胞的成熟与功能,组织驻留巨噬细胞又反过来与其微环境相互作用,共同维持组织与机体的稳态。许多驻留巨噬细胞与其驻留的微环境中的其他细胞类群在进化上是保守的。例如,人和小鼠的Kupffer细胞均位于肝窦中,位于肝窦内皮细胞的顶部,形成肝细胞和血液之间的屏障,这种共进化模式表明了巨噬细胞及其组织微环境功能相互作用。空间转录组学、蛋白质组学、高度多重免疫荧光技术、类器官等技术的综合应用,能够精细解析这些细胞间相互作用及其背后的分子机制 (图1C)。
5. 解码组织驻留巨噬细胞的功能
深度分析临床样本中的巨噬细胞有助于理解人体巨噬细胞在疾病中的角色,巨噬细胞的异质性、丰度、表型、功能状态和基因表达模式已被证明与某些疾病的进展阶段相关联。疾病状态下巨噬细胞亚型的特征表达模式有望被用于疾病诊断、进展和预后,进一步结合功能实验,有助于发现潜在的治疗靶点。使用类器官-巨噬细胞共培养系统可以有效的帮助研究人员更多地了解巨噬细胞如何影响器官发育、体内平衡和疾病。例如,最近共同培养人脑类器官和诱导的原始巨噬细胞的研究表明,小胶质细胞可以通过提供特定代谢物来调节神经元分化。为了研究人小胶质细胞在中枢神经系统疾病(如阿尔茨海默病)中的作用,可以采用这种使用类脑器官的系统,特别是来源于患者细胞的类器官系统。
尽管啮齿类动物特别是小鼠,被广泛用于研究组织驻留巨噬细胞的功能。但是,特定巨噬细胞群,如皮肤中的小胶质细胞样细胞,在小鼠或大鼠中并不存在。不同物种的单细胞转录组的比较研究有助于识别细胞群同源关系并确定功能研究适合的动物模型。更好地了解跨物种组织驻留巨噬细胞群的相似性和差异对于选择最合适的动物模型来研究特定巨噬细胞功能及其在各种疾病中的作用至关重要。在常用的实验动物中,非人灵长类动物和猪值得注意,这些物种在进化、生理或基因方面与人更接近,有可能提供人体免疫反应和巨噬细胞功能的更高相似性和多样性,达到更有效的临床前实验和靶向治疗(图1D)。
本文总结了关于人体巨噬细胞多样性、发展和功能的最新研究进展,指出综合应用多种研究策略有助于理解人体巨噬细胞这一免疫学的前沿科学问题,对理解人体健康和疾病具有深远的意义。该研究获国家科技部重点研发计划、国家自然科学基金、深圳市科技计划、深圳市医学重点学科建设基金、复旦大学启动基金及深圳合成生物学创新研究院等项目的支持。
本文参考文献(上线划动查看)
Bao, Y., Wang, G. and Li, H., 2024. Approaches for studying human macrophages. Trends in Immunology.
Blériot, C., Chakarov, S. and Ginhoux, F., 2020. Determinants of resident tissue macrophage identity and function. Immunity, 52(6), pp.957-970.
Wang, Z., Wu, Z., Wang, H., Feng, R., Wang, G., Li, M., Wang, S.Y., Chen, X., Su, Y., Wang, J. and Zhang, W., 2023. An immune cell atlas reveals the dynamics of human macrophage specification during prenatal development. Cell, 186(20), pp.4454-4471.
Mass, E., Nimmerjahn, F., Kierdorf, K. and Schlitzer, A., 2023. Tissue-specific macrophages: how they develop and choreograph tissue biology. Nature Reviews Immunology, 23(9), pp.563-579.

论文作者介绍

李汉杰
研究员
李汉杰,研究员,博士生导师。李汉杰课题组采用“数据和假说双驱动”的研究范式,利用计算生物学,分子细胞生物学,临床样本和动物模型,深入探究人体免疫细胞在发育,健康及疾病状态下的发育分化与功能。以通讯或第一作者(含共同)发表多篇高水平论文,包括Cell(2023,2019)、Cell Research(2020,2012)、Cell Reports Medicine (2024) 、Cellular and Molecular Immunology、Cell Discovery、Cell Reports等期刊,总引用超3800次。成果入选2023年国内十大科技新闻(科技日报),2023年深圳市科技创新十件大事(深圳特区报)。曾荣获欧盟“玛丽-居里奖学金”、德国“洪堡学者”。作为首席科学家,主持科技部重点研发计划“发育编程及其代谢调节”重点专项。李汉杰实验室长期招收计算生物学、分子细胞生物学、免疫学、基础医学研究生/博士后,欢迎有志之士前来咨询并加入我们的研究团队。(邮箱:hj.li@siat.ac.cn)。
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊Trends in Immunology,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Approaches for studying human macrophages
▌论文网址:
https://www.cell.com/trends/immun-ology/fulltext/S1471-4906(24)00032-2
▌DOI:
https://doi.org/10.1016/j.it.2024.02.007
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




