- +1
CRMed:吴晨团队揭示食管鳞癌化疗新靶点
原创 Cell Press CellPress细胞科学生命科学
Life science
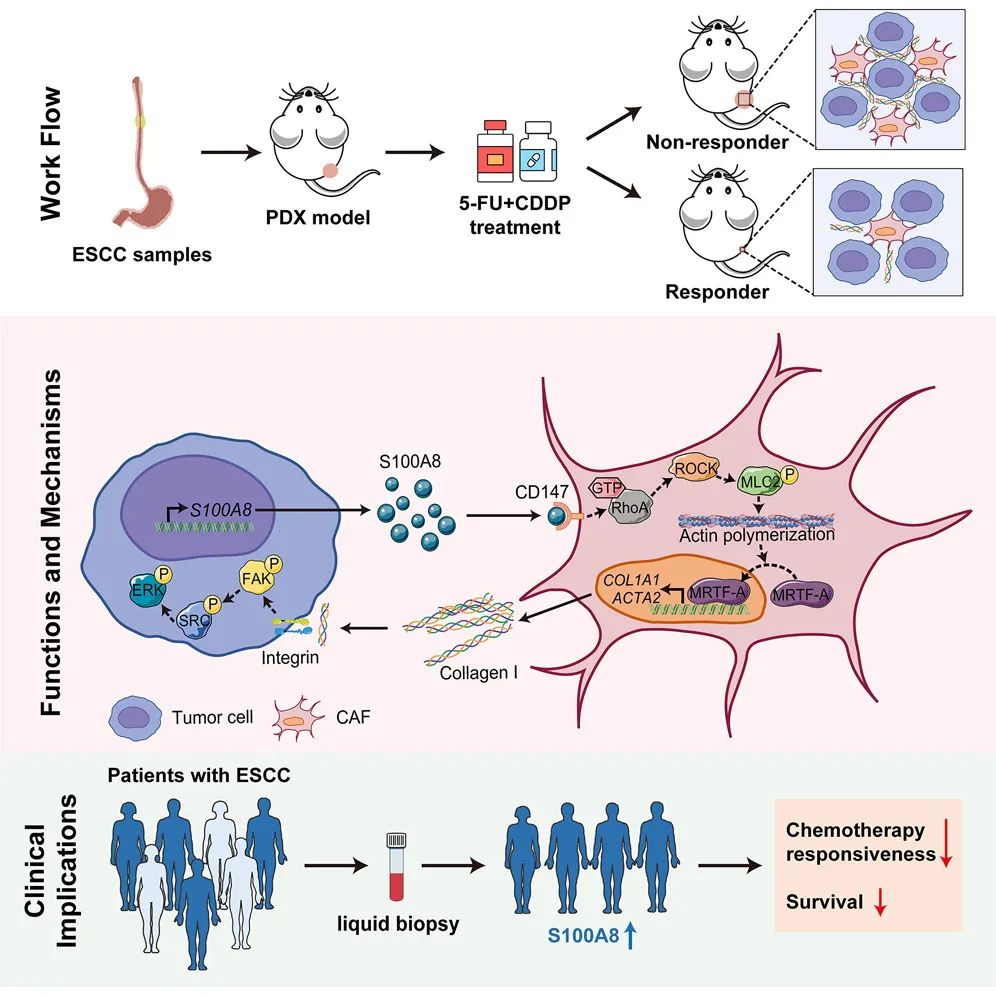
2024年5月21日,国家癌症中心/中国医学科学院肿瘤医院吴晨教授团队在Cell Press细胞出版社期刊Cell Reports Medicine发表了一篇论文,题为“Alarmin S100A8 imparts chemoresistance of esophageal cancer by reprograming cancer-associated fibroblasts”。该研究通过构建人源肿瘤异种移植模型(patient-derived xenografts,PDX),系统揭示了食管鳞癌化疗耐药的分子机制,提出了可增强化疗敏感性的潜在治疗靶点和预测化疗反应性的液体活检标志物。
食管癌是全球高发的恶性肿瘤之一,在我国,食管癌的发病率和死亡率均居世界首位。与欧美国家以腺癌为主的病理特征不同,在我国食管鳞癌是主要的病理类型,其预后差、恶性程度高,是一类治愈率极低的肿瘤。食管癌起病隐匿,临床上将近70%的患者确诊时已处于局部晚期,丧失了最佳手术机会。对于中晚期食管鳞癌患者,目前的一线标准治疗是双药化疗,但是单纯化疗疗效欠佳,有效率仅在30%左右,中位生存时间不足一年,因此亟需更有效的治疗策略来改善食管癌患者的生存和预后。近年来,以免疫检查点抑制剂为代表的免疫治疗为食管癌治疗带来了新的契机。国内外科学家开展了多项Ⅲ期临床试验并取得了重大进展,证实了免疫检查点抑制剂联合化疗对于中晚期食管鳞癌患者的有效性,免疫联合化疗已成为中晚期食管鳞癌的一线治疗方法。然而,当前的免疫治疗策略仍存在患者疗效响应不一、获益靶点不清楚的难题。由于食管鳞癌免疫原性差,我们不能忽视化疗在联合免疫治疗中的应用,因此研究食管鳞癌化疗耐药机制、开发潜在的化疗增敏靶点,有助于延长患者的生存期,改善患者预后。
近日,国家癌症中心/中国医学科学院肿瘤医院吴晨教授团队在临床前环境中系统研究了食管鳞癌化疗耐药机制,发现了肿瘤细胞分泌的警报素分子S100A8是潜在的化疗增敏靶点。S100A8可重编程肿瘤相关成纤维细胞,诱导其向促癌表型极化,并最终导致化疗耐药。研究结果全文在Cell Reports Medicine发表。
吴晨教授团队多年来建立了大规模的食管鳞癌PDX队列。在这项研究中,团队利用已建立的PDX模型开展了化疗敏感性实验,结合转录组测序和单细胞测序数据分析,揭示了肿瘤微环境中由S100A8介导的肿瘤细胞-基质细胞异常相互作用,并由此导致的化疗耐药。研究团队进一步在PDX模型中证实了靶向S100A8介导的肿瘤相关成纤维细胞重编程可显著提高化疗效率,并在食管鳞癌临床化疗队列中发现外周血S100A8水平可预测化疗反应性。该研究从肿瘤微环境的角度系统地剖析了食管鳞癌化疗耐药机制,并强调了警报素S100A8在临床管理中的潜在价值。
作者专访
Cell Press细胞出版社公众号特别邀请吴晨教授代表研究团队接受了专访,为大家进一步详细解读。
CellPress:
近年来食管癌的研究现状如何?
吴晨教授:
食管癌是我国高发的恶性肿瘤,在我国食管癌的发病率和病死率约占全球的一半,并且我国 90%以上病例为食管鳞癌。食管鳞癌起病隐匿,多数患者在初诊时已处于局部晚期或转移状态,这也是造成我国食管癌患者生存率低和预后差的主要原因。因此,早诊早治已经成为食管癌防治“关口前移”的重要策略。我们团队前期的研究揭示了人体正常细胞基因组变异模式和食管癌变过程微环境动态改变的机制,并解析了驱动正常食管上皮细胞癌变的基因组突变特征,为开发有效的早诊早治检测技术提供了重要科学依据。早期食管癌主要在内镜下或通过外科手术切除,对于丧失手术机会的中晚期食管癌,主要的治疗手段包括传统的放、化疗和新兴的靶向治疗、免疫治疗等。近年来国内科学家在联合免疫治疗方面取得了突破性进展,改写了食管癌的治疗指南,为食管癌新辅助治疗的探索指明了方向。多项Ⅲ期临床试验结果表明PD-1单抗联合化疗已成为晚期食管癌的标准一线治疗,这些成果显著提升了患者的五年生存率。相信随着研究的进一步深入,食管癌诊断和治疗将更加规范和个性化,患者的预后将进一步改善。
CellPress:
本项研究对指导食管癌治疗有哪些具体意义?
吴晨教授:
尽管免疫治疗逐步成为研究热点,但由于食管鳞癌免疫原性差、免疫治疗获益人群少等因素,食管鳞癌一线治疗目前无法摒弃化疗和放疗,并且主流的联合免疫治疗手段均以化疗为基础,所以我们在基础研究过程中仍要重视对化疗的研究。由于复杂的化疗耐药机制存在,化疗的总体疗效欠佳,因此研究食管癌化疗耐药机制、开发潜在的化疗增敏靶点,有助于延长临床上化疗和免疫联合化疗患者的生存期。本项研究利用食管鳞癌PDX模型系统揭示了食管鳞癌化疗耐药的分子机制,发现了一个潜在的化疗增敏靶点S100A8,并在临床前模型上进一步证实了靶向S100A8提高化疗效率的可行性。更重要的是,我们使用大规模的临床食管癌化疗队列,发现外周血S100A8的水平可作为预测化疗反应性的非侵入性生物标志物。同时根据外周血S100A8的含量,我们可以对患者进行分层,预测患者对化疗的应答程度,然后对于不同应答程度的患者给予合适的治疗策略,这也能在一定程度上降低化疗给患者带来的毒副作用。总之,我们的研究发现为临床上更精准地评估食管癌患者对化疗的反应性,并改善接受化疗和免疫联合化疗患者的预后提供了重要依据。
CellPress:
本项研究还有哪些亮点?
吴晨教授:
癌症进展和治疗耐药是肿瘤细胞和肿瘤微环境之间异常相互作用的关键结果,解析肿瘤细胞和肿瘤微环境的相互作用对于制定有效的抗癌策略至关重要。本研究基于PDX模型,该模型较传统皮下移植模型能更好地保留患者原发肿瘤的微环境特征,有助于研究肿瘤基质成分如何介导癌症进展。同时,我们能够在PDX模型上直接验证我们发现的治疗靶点的抗癌价值。再有,本研究纳入的PDX模型样本量大,原发肿瘤涵盖了食管癌的不同病理阶段,能够更好地反映临床真实情况。最后,本研究发现的潜在治疗靶点S100A8是一种分泌型小分子蛋白,这意味着在循环血液中检测S100A8的含量来预测化疗反应性成为可能,我们也在临床队列中证实了S100A8的预测价值。
CellPress:
目前的食管癌研究还有哪些值得探讨的方向?
吴晨教授:
在全世界范围内,食管癌转化研究的难点在于缺少合适的临床前动物模型。虽然我们团队长期建立了多个食管癌PDX模型,在食管癌的放化疗和靶向治疗研究中发现了多个有价值的治疗靶点,但由于PDX基于免疫缺陷小鼠,其缺乏功能性的免疫细胞,因此亟需开发更能代表食管癌发生、进展的转基因小鼠模型。同时,能够指导食管癌早期诊断和预后评估的分子标志物的开发也是亟待解决的临床难题。未来研究应致力于解析食管癌变过程中的动态分子变化及肿瘤微环境改变,探究介导食管癌发生、进展和治疗抵抗的非侵入性生物标志物,为实现食管癌的精准预防和个体化治疗奠定基础。食管癌研究应更多地关注临床迫切需求,将基础研究成果转化为行之有效的诊疗方法,以真正造福患者。

作者介绍

吴晨
教授
通讯作者:吴晨,中国医学科学院北京协和医学院长聘教授、博士生导师,国家癌症中心/中国医学科学院肿瘤医院副院长、研究员,昌平国家实验室领衔科学家。长期从事肿瘤遗传学和基因组学的基础创新和临床转化研究。通过开展覆盖食管癌全病程的大规模前瞻性研究队列,建立肿瘤基因组动态样本库和大数据库,构建癌变及进展风险预测模型,系统揭示遗传与环境因素交互作用在肿瘤发生中的作用机制;系统绘制正常人体多器官组织中体细胞突变图谱,采用多组学数据挖掘和生物学功能阐释紧密结合的研究范式,深入挖掘肿瘤基因组动态演进分子机制,推动肿瘤精准防治。已发表SCI论文143篇,包括以通讯或第一作者(含共同)在Nature, Cancer Cell, Nature Genetics, Nature Medicine等国际权威学术期刊,累计他引用量为7,800余次,研究成果被多家国际权威期刊专题评述。入选国家杰出青年科学基金、教育部长江学者,曾获国务院政府特殊津贴、腾讯科学探索奖医学科学奖(2023年)、全球青年领袖、中国青年科技奖、中国青年五四奖章、中国青年女科学家奖,全国抗击新冠肺炎疫情先进个人等。科研成果获国家自然科学奖二等奖、教育部自然科学奖一等奖、教育部科学技术进步奖二等奖等。
其他作者:本文的第一作者是中国医学科学院肿瘤医院吴晨教授的博士研究生陈新杰,研究方向为食管癌恶性演化的驱动机制与治疗抵抗机制。本文的共同作者包括程国煜博士、朱亮博士、刘天媛博士、杨心语博士和张少森博士。
相关论文信息
论文原文刊载于Cell Press细胞出版社
▌论文标题:
Alarmin S100A8 imparts chemoresistance of esophageal cancer by reprograming cancer-associated fibroblasts
▌论文网址:
https://www.cell.com/cell-reports-medicine/fulltext/S2666-379
原标题:《CRMed:吴晨团队揭示食管鳞癌化疗新靶点 | Cell Press对话科学家》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




