- +1
Science:浙江大学林世贤团队报道稀有密码子重编码技术
 在自然界中,几乎所有生物体的蛋白质都是由20种天然氨基酸组成,这些氨基酸的排列组合形成了种类和功能各异的蛋白质,进而让生物体可以执行复杂的功能。不同于20种天然氨基酸,非天然氨基酸具有多样化的侧链基团,可以赋予蛋白质更优的或全新的物理、化学或生物特性。
在自然界中,几乎所有生物体的蛋白质都是由20种天然氨基酸组成,这些氨基酸的排列组合形成了种类和功能各异的蛋白质,进而让生物体可以执行复杂的功能。不同于20种天然氨基酸,非天然氨基酸具有多样化的侧链基团,可以赋予蛋白质更优的或全新的物理、化学或生物特性。因此,实现非天然氨基酸在生命体中的遗传编码,将有助于设计并构建出具有全新功能的蛋白质,甚至改造出全新形式的细胞和生命体,促进基础和应用研究。
然而在细胞或生命体中遗传编码非天然氨基酸困难重重。经过几亿年的进化,几乎所有的生命体都在使用同一套遗传密码表,并且表中的64个密码子都被充分地用于编码20种天然氨基酸,因此理论上没有空间可供非天然氨基酸的编码。
2024年6月7日,浙江大学林世贤实验室(博士后丁文龙、博士生于微和博士后陈宇霖为论文共同第一作者)在 Science 期刊发表了题为:Rare codon recoding for efficient noncanonical amino acid incorporation in mammalian cells 的研究论文。
该研究工作另辟蹊径,提出了使用特定的稀有密码子代替空白密码子用于遗传编码非天然氨基酸的新思路,设计并开发了名为“稀有密码子重编码”(Rare Codon Recoding,RCR)的非天然氨基酸编码体系。
通过系统的工程改造和核酸序列的大数据模型预测,稀有密码子重编码技术以接近天然氨基酸的编码效率高效合成系列带有非天然氨基酸的功能蛋白质,并在哺乳动物细胞中首次成功合成带有6个位点非天然氨基酸和4种不同类型非天然氨基酸的蛋白质。

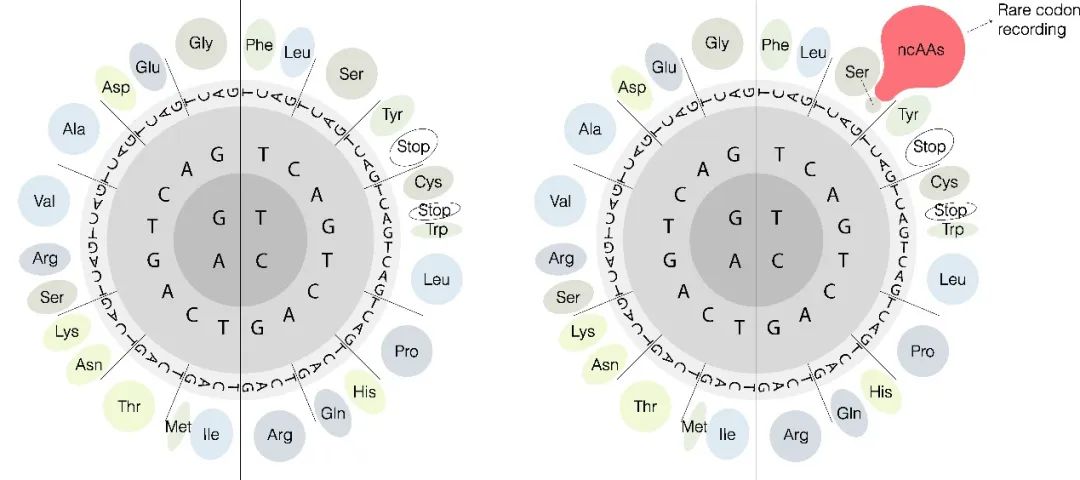 图1. 左:经典的遗传密码表;右:RCR技术重构的遗传密码表 (图片设计:朱原之,于微)
图1. 左:经典的遗传密码表;右:RCR技术重构的遗传密码表 (图片设计:朱原之,于微)在这项研究中,研究团队首先指出遗传密码扩展技术(Genetic Code Expansion,GCE)中非天然氨基酸的低效率编码是翻译释放因子的强劲竞争所致。因此可通过使用有义密码子替换终止密码子用于编码非天然氨基酸,来规避翻译释放因子的竞争。而有义密码子的冗余性为重新分配简并密码子用于编码新的氨基酸提供了操作空间。且在61种有义密码子中,存在一类使用频率低于1%的密码子——稀有密码子,稀有密码子往往对应较低水平的解码tRNA(Decoding-tRNA,Dec-tRNA)。研究团队提出通过设计鲁棒性强的重编码tRNA(Recoding-tRNA,Rec-tRNA)用来竞争较弱的解码tRNA,以实现将稀有密码子高效重编码成为非天然氨基酸。
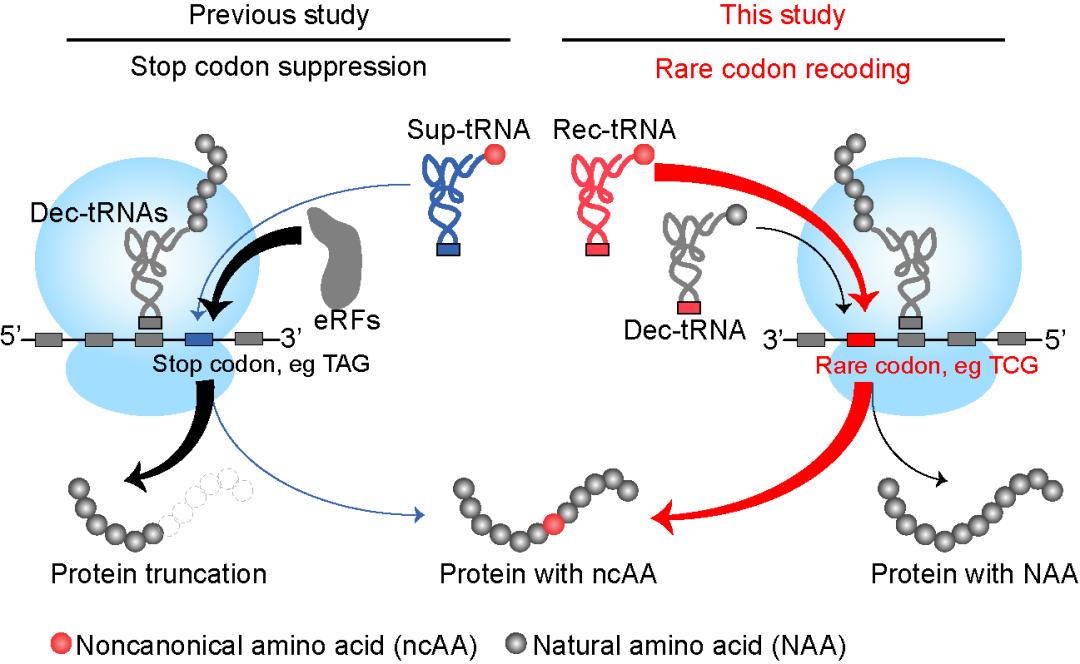 图2. 稀有密码子重编码体系的原理示意图
图2. 稀有密码子重编码体系的原理示意图基于该设想,研究团队认为用于编码非天然氨基酸的理想稀有密码子应具备以下特性:
1)内源解码tRNA丰度低;
2)在转录本上使用频率较低;
3)对应的重编码tRNA可被对应的正交合成酶有效识别;
4)其周围的序列可被理性改造用于提高重编码效率。
基于这一思路,研究团队通过分析所有61种有义密码子的使用频率和内源解码tRNA丰度,筛选出7种具有重编码潜力的稀有密码子,并通过系列实验,确定了TCG是最具重编码潜力的稀有密码子。随后,研究团队优化了TCG重编码系统在哺乳动物细胞中的非天然氨基酸编码效率,实现以接近天然氨基酸的编码效率表达系列带有非天然氨基酸的功能蛋白质。研究团队同时证明在TCG重编码系统工作时,表达体系的宿主细胞能够维持正常的转录、翻译和增殖等功能。
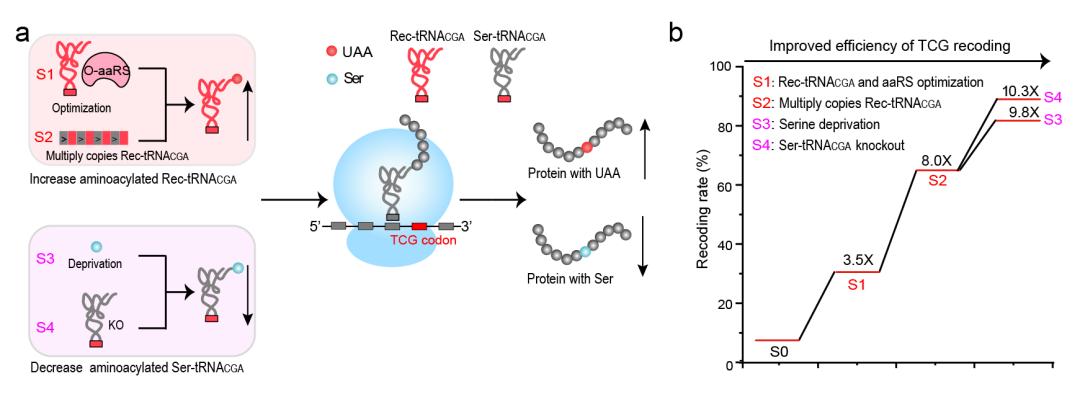 图3. 稀有密码子重编码体系的效率优化
图3. 稀有密码子重编码体系的效率优化对于稀有密码子重编码体系来说,重编码的选择性是关键因素。研究团队采用了相分离表达体系,将靶蛋白转录本和重编码翻译元件聚集在特定“无膜细胞器”的空间中实现重编码,降低了转录组上背景TCG的重编码水平。实验过程中,研究团队发现TCG密码子周围的核酸序列严重影响其重编码效率。基于此发现,研究团队利用了化学蛋白质组学手段对转录组中含有TCG密码子的核酸序列进行富集和定量分析;再结合线性回归算法,提出依据TCG密码子周围序列来预测重编码效率的回归模型;并验证了回归模型对于重编码效率提升的可行性和通用性。
最后,研究团队发现稀有密码子重编码体系对于主要的非天然氨基酸翻译系统都有兼容性和通用性,验证了十余种被不同翻译系统识别的功能非天然氨基酸都可被稀有密码子重编码体系高效地重编码。并且,利用稀有密码子重编码体系,研究团队还首次实现在单一蛋白质中同时编码多达6个位点和4种不同类型的非天然氨基酸,充分展示了稀有密码子重编码体系的优越性。
论文链接:
https://www.science.org/doi/10.1126/science.adm8143
 阅读原文
阅读原文本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




