- +1
Nature子刊:梁海华/乐率团队揭示噬菌体调控病原菌致病性并逃逸宿主免疫反应的新机制
 在长达30亿年的细菌-噬菌体斗争过程中,噬菌体已经进化出了多种策略来克服细菌的防御机制,并操纵细菌的生物合成以确保噬菌体的成功繁殖,这些功能通常是由不同噬菌体蛋白来完成的。与此同时,细菌也进化出了大量抵抗噬菌体的元件,这些元件包括核酸酶、解旋酶、蛋白酶和激酶。其中,来自RM系统(限制性修饰)和CRISPR-Cas系统的核酸酶能切割噬菌体DNA,已被广泛研究。然而,蛋白酶在噬菌体防御中的作用却鲜有研究。
在长达30亿年的细菌-噬菌体斗争过程中,噬菌体已经进化出了多种策略来克服细菌的防御机制,并操纵细菌的生物合成以确保噬菌体的成功繁殖,这些功能通常是由不同噬菌体蛋白来完成的。与此同时,细菌也进化出了大量抵抗噬菌体的元件,这些元件包括核酸酶、解旋酶、蛋白酶和激酶。其中,来自RM系统(限制性修饰)和CRISPR-Cas系统的核酸酶能切割噬菌体DNA,已被广泛研究。然而,蛋白酶在噬菌体防御中的作用却鲜有研究。2024年6月17日,南方科技大学梁海华、陆军军医大学乐率等在 Nature Microbiology 期刊发表了标题为:Bacteriophage protein Dap1 regulates evasion of antiphage immunity and Pseudomonas aeruginosa virulence impacting phage therapy in mice 的研究论文。
该研究发现了铜绿假单胞菌噬菌体PaoP5中的噬菌体蛋白Dap1具有双重功能:调控宿主细菌行为和防御Lon蛋白酶介导的新型噬菌体抵抗机制。此外,Dap1可提高噬菌体的生存优势、显著提升噬菌体治疗效率。
研究团队首先探索了裂解性噬菌体PaoP5的早期表达蛋白对铜绿假单胞菌PAO1的影响,发现噬菌体的Dap1蛋白可通过与c-di-GMP磷酸二酯酶DipA结合并干扰其功能,使细胞内c-di-GMP水平提高,从而抑制细菌运动,增强生物被膜形成能力。
此外,在铜绿假单胞菌感染的小鼠模型中发现,过表达Dap1蛋白会显著降低细菌毒力,这表明噬菌体可能通过其编码蛋白抑制铜绿假单胞菌的致病性。这一发现不仅丰富了我们对噬菌体与细菌相互作用的理解,而且为开发针对铜绿假单胞菌的小分子抑制剂提供了全新的策略和思路。
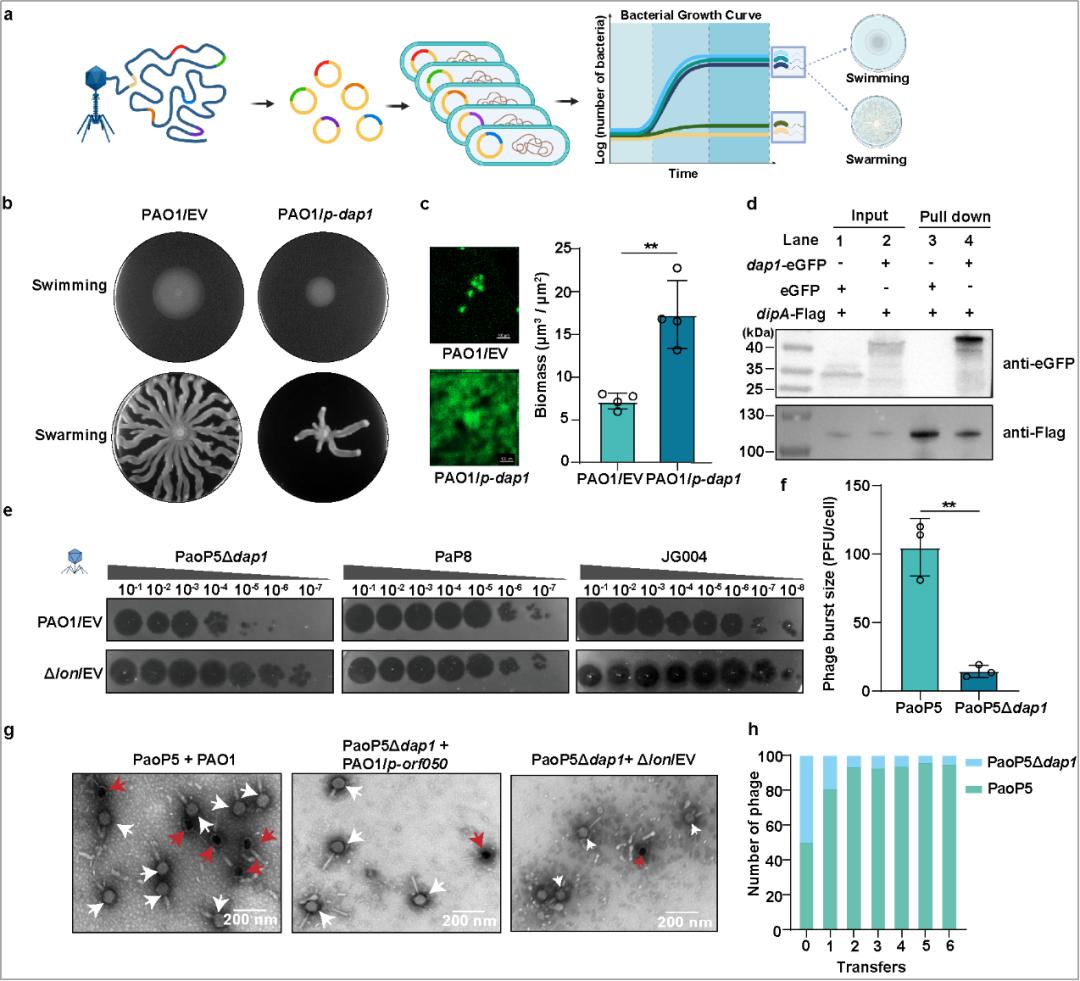 图1:噬菌体Dap1蛋白既能抑制铜绿假单胞菌毒力又能反宿主的噬菌体防御、并能显著提升噬菌体治疗效率
图1:噬菌体Dap1蛋白既能抑制铜绿假单胞菌毒力又能反宿主的噬菌体防御、并能显著提升噬菌体治疗效率同时,在PaoP5中删除dap1基因会显著抑制噬菌体的适应性并导致噬斑变小。研究团队先通过蛋白质组技术,发现了dap1的缺失会导致噬菌体的HNH核酸酶显著减少。HNH核酸酶与噬菌体末端酶共同参与了噬菌体基因组的包装。因此,PaoP5 Δdap1产生的子代大多数缺少基因组,使得噬菌体的爆发量显著下降。进而,研究团队提出一种假设:噬菌体的HNH核酸酶可以被细菌的防御系统降解,而Dap1蛋白是一种反防御蛋白,从而保护了HNH核酸酶不被降解。生化实验证实了这一假设,细菌的LON蛋白酶可直接降解噬菌体的HNH核酸酶,表明细菌的蛋白酶是一种全新的噬菌体防御元件;而Dap1蛋白则可以通过与HNH核酸酶结合,实现反防御作用,抵抗LON蛋白酶的降解。
在小鼠模型中,研究团队发现,噬菌体PaoP5Δdap1的治疗效果效率显著低于野生株PaoP5,且在PaoP5Δdap1处理的小鼠中,细菌清除率也明显下降。上述结果表明,噬菌体产生子代噬菌体的数量对噬菌体治疗的成功至关重要,高效的噬菌体自我复制是噬菌体治疗成功的优势和关键因素。
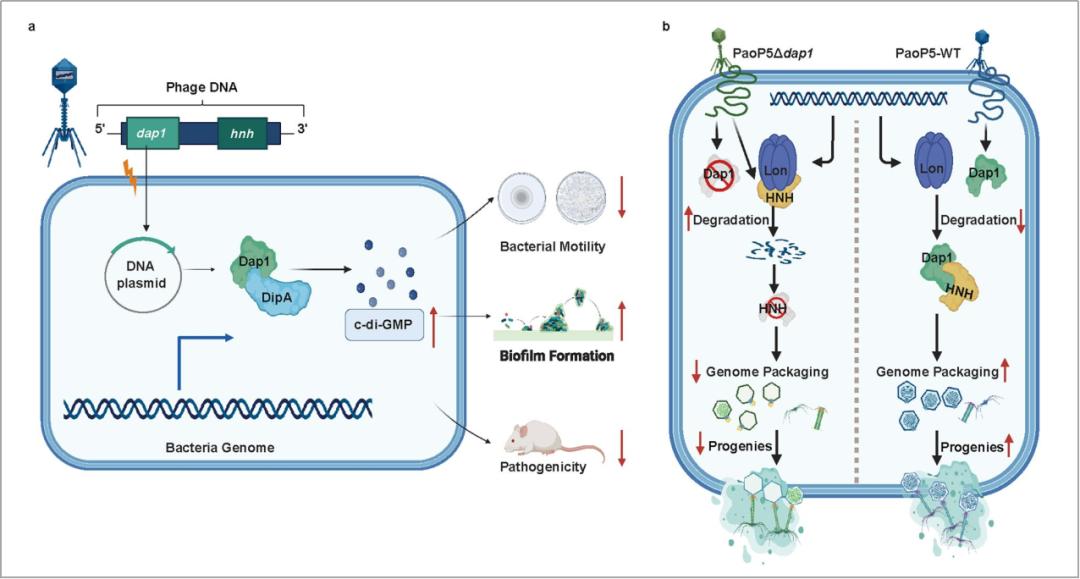 图2:噬菌体Dap1蛋白抑制细菌毒力及逃避细菌防御系统的机制示意图
图2:噬菌体Dap1蛋白抑制细菌毒力及逃避细菌防御系统的机制示意图综上,该研究深入揭示了噬菌体蛋白Dap1的双重功能:它不仅能够调控细菌的行为,而且还能帮助噬菌体逃避由细菌Lon蛋白酶所介导的噬菌体防御,显著提升了噬菌体的适应性和生存能力。这些发现不仅为我们理解噬菌体如何通过进化策略来增强其在宿主环境中的适应性提供了新视角,也为噬菌体疗法的开发和应用提供了潜在的新思路。
南方科技大学梁海华教授为论文通讯作者,陆军军医大学乐率副教授、王竞副教授、南方科技大学访问学生卫蕾蕾为论文共同第一作者。该研究得到了科技部重点研发计划、国家自然科学基金以及深圳市科创委重点项目的资助。
论文链接:
https://www.nature.com/articles/s41564-024-01719-5
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




