- +1
上海科技大学刘艳芬/仓勇团队Trends in Biochemical Sciences综述
原创 Cell Press CellPress细胞科学

生命科学
Life science
近日,上海科技大学的刘艳芬教授团队和仓勇教授团队在Cell Press细胞出版社旗下期刊Trends in Biochemical Sciences发表了题为“Routes to molecular glue degrader discovery”的综述文章。该文全面系统地总结了近期关于分子胶的研究,着重介绍了它们多样的作用机制,并探讨了发现新型分子胶和新底物的策略。
有兴趣在Trends in Biochemical Sciences发表您的综述文章?请扫描提交论文提案 (presubmission inquiry)。
现代生物医学的探索之路上,攻克疾病一直是科学家们不懈追求的目标。作为生命活动的核心执行者,蛋白质的异常往往与多种疾病的发生和发展密切相关。近年来,分子胶降解剂作为一种新兴的靶向蛋白降解技术,在生物医学领域展现出巨大的潜力,为治疗那些曾经难以攻克的疾病带来了前所未有的希望。本综述概述了近期报道的分子胶降解剂,探讨了基于分子胶的作用机制来寻找新型分子胶和底物的策略,并分析了当前分子胶发展和应用中面临的挑战,同时提出了未来可能的改进方向。
分子胶和PROTAC的区别
分子胶和 PROTAC 作为靶向蛋白降解的两类重要化合物,都利用泛素-蛋白酶体途径来消除与疾病相关的蛋白质[1, 2]。PROTAC 由一个靶标结合弹头和一个 E3 泛素连接酶结合配体组成,二者通过一个柔性连接子相连。而分子胶能在E3泛素连接酶和底物之间建立新的相互作用,且不需要单独与这两种蛋白中的任何一种有强制性结合(图1A)。相比之下,分子胶具备分子量小、成药性好等多种优势[3]。
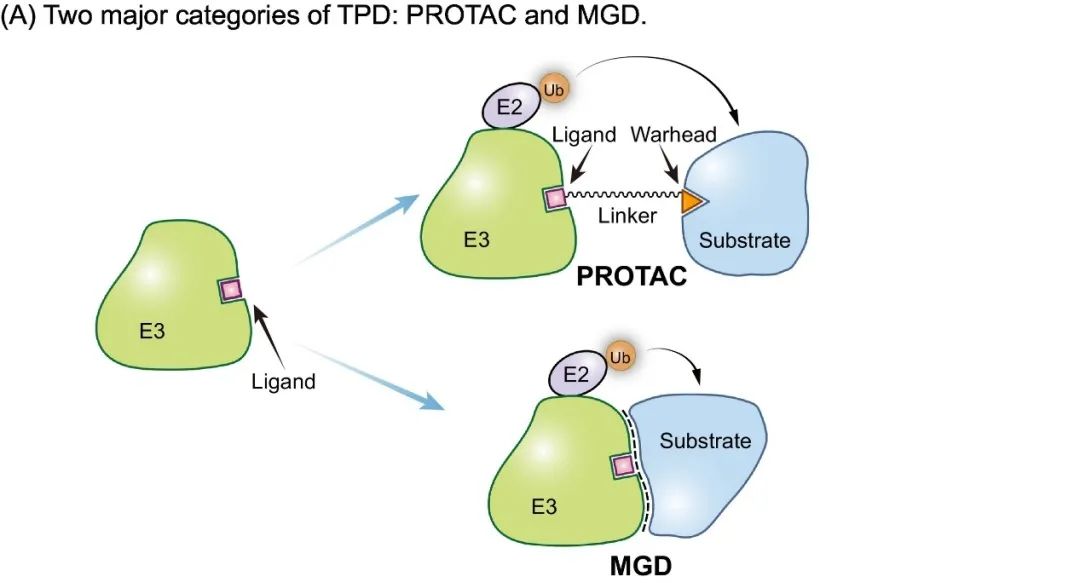
▲图1A. 靶向蛋白降解技术的两种策略:PROTAC和分子胶。
基于CRBN的沙利度胺及其衍生物分子胶
沙利度胺曾因其严重的致畸作用而声名狼藉,并被迅速撤出市场。然而科学家们并未因此放弃该药物。后续研究令人惊喜地发现,沙利度胺能够与CUL4-DDB1 E3泛素连接酶(CRL4CRBN)的底物受体CRBN结合[4],并诱导某些转录因子,如IKZF1和IKZF3的泛素化和降解,这些转录因子在正常情况下不会被识别为降解底物。基于这一独特机制,来那度胺和泊马度胺等衍生物应运而生,它们在治疗多发性骨髓瘤等疾病方面展现出了显著疗效,成为临床上抗击癌症的强大工具(图1B)。
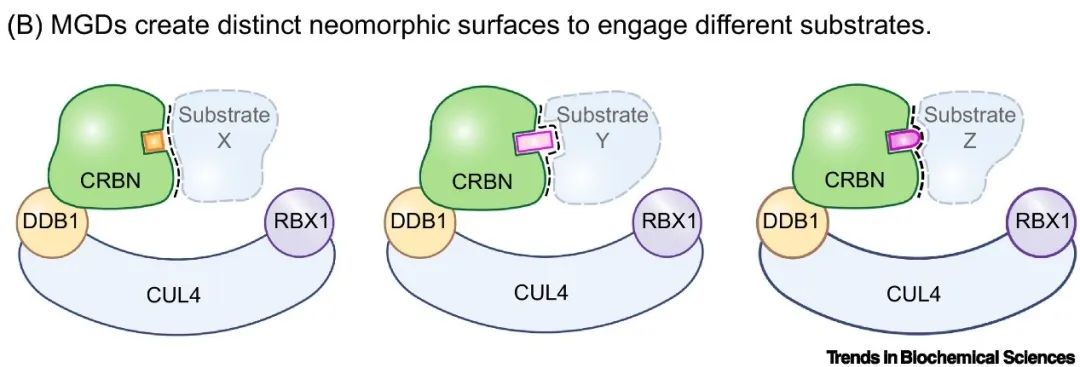
▲图1B. 基于CRL4CRBN的分子胶降解剂通过在底物受体CRBN上产生独特的新结构界面,以此结合不同的底物。
基于其他E3泛素连接酶的分子胶
随着研究的深入,科学家们利用创新的蛋白质阵列筛选技术,成功发现了一类能与E3泛素连接酶CRL2VHL的底物受体VHL结合的分子胶。这类分子胶能够使VHL招募新的底物,即半胱氨酸双加氧酶(CDO1)[5]。这一发现为拓展可降解的蛋白质底物的种类提供了新的方向。此外,CRL4DCAF15的底物受体DCAF15与分子胶indisulam 的相互作用则揭示了磺胺类分子在特异性靶向RNA结合蛋白RBM39,并抑制特定癌细胞生长方面的巨大潜力[6]。
这些神奇的分子胶是如何被发现的?科学家们探索了一系列创新的策略加以应用。一种通用的方法是从筛选 E3 泛素连接酶的配体开始,首先根据E3连接酶的表达谱或亚细胞定位,选择感兴趣的靶点。之后通过高通量文库筛选或利用现有抑制剂的结构引导的构效关系(SAR)研究,精准识别出与E3连接酶底物接收结构域结合的小分子配体化合物[7]。这些小分子配体化合物犹如钥匙,为设计和合成化学多样性文库奠定基础。文库中的小分子配体化合物与E3连接酶结合并修饰其表面,产生新的界面,从而招募和降解特定的新底物(图2A)。
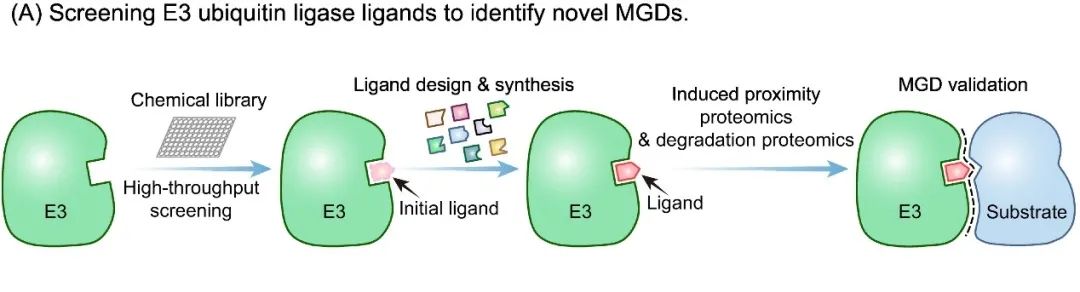
▲图2A.通过筛选E3泛素连接酶的小分子配体化合物以寻找新型分子胶降解剂。
基于底物的分子胶
根据最近的研究,开发能够与特定靶标结合的小分子化合物成为了一种创新途径,它们不仅可以抑制靶标的功能,还能够充当分子胶。这些基于底物的分子胶通过与底物蛋白结合,诱导产生能被特定E3泛素连接酶识别的新结构界面,从而标记目标蛋白及其相关蛋白进行降解。以细胞周期蛋白依赖性激酶 12(CDK12)抑制剂为例,它们能够在与 CDK12 结合时,意外地创造出一个全新的结构界面,吸引E3泛素连接酶CRL4的DDB1亚基,将 CDK12 转化为 CRL4的新型底物受体,进而靶向降解与CDK12相互作用的细胞周期蛋白K(Cyclin K)[8]。因此,通过对小分子抗癌药物进行系统性筛选,寻找能够与底物协同作用、形成新的结构界面,并诱导与E3泛素连接酶结合的化合物,也成为开发基于底物的分子胶的有效途径(图2B)。
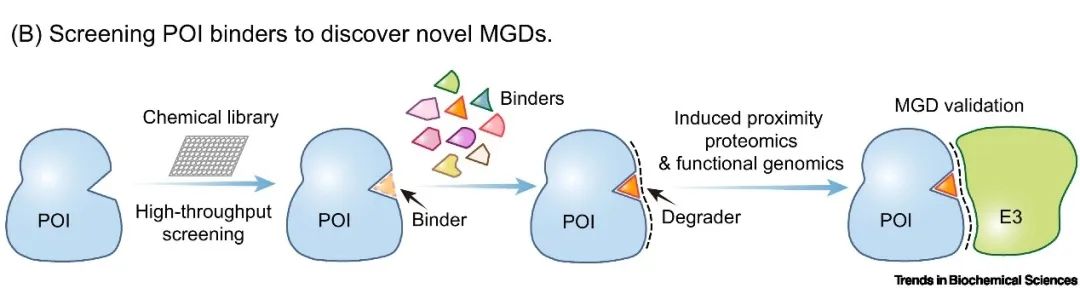
▲图2B.通过筛选感兴趣的底物蛋白的结合物来寻找新型分子胶水。
分子间和分子内降解剂
分子胶家族中还有一些独特的成员,如分子间降解剂BI-3802,展现了其独特的降解机制。BI-3802能够诱导致癌转录因子BCL6发生高度特异性且可逆的聚合,使其聚集在一起,然后被E3泛素连接酶SIAH1识别并降解[9]。这种机制通过操控蛋白质的聚合状态,从而实现对致病蛋白的精准抑制。此外,BRD2和BRD4的分子内二价分子胶(IBGs)则通过桥接相邻的BRD蛋白结构域,进而通过CRL4DCAF16促进其降解[10]。这一策略类似于在蛋白质内部搭建了一座“桥梁”,引导其走向降解,为高效靶向降解蛋白质开辟了全新的路径。
然而,如同任何新兴技术一样,分子胶在临床应用的进程中面临着诸多挑战。其中,特异性和选择性是亟待解决的关键问题之一。由于细胞内蛋白质网络的高度复杂性,分子胶可能会与一些非预期的蛋白质相互作用,产生脱靶效应。为了提高分子胶的特异性,研究人员正在积极研发更为精准的筛选技术。如DNA编码文库(DEL)筛选和结构引导的构效关系(SAR)研究,通过对化合物结构的精细优化,增强其与目标蛋白的结合亲和力,同时减少与非靶标蛋白的结合。
另外,耐药性也是分子胶面临的一大挑战。随着治疗时间的推移,癌细胞可能会发展出各种耐药机制,使分子胶的疗效逐渐减弱。为了应对这一挑战,研究人员正在探索通过同时靶向疾病通路中的多个关键节点,或者设计不同的分子胶以绕过癌细胞的耐药屏障,让癌细胞难以逃脱治疗。
总结与展望
尽管分子胶目前还存在一定的局限性,但它无疑已经为靶向蛋白降解治疗开辟了一条全新的道路。现有的分子胶尚无法靶向所有的底物。因此,探索新的E3泛素连接酶工具库将有助于进一步扩大分子胶的适用范围。
供稿:李栋
本文参考文献(上下划动查看)
1. Békés, M. et al. (2022) PROTAC targeted protein degraders: the past is prologue. Nature Reviews Drug Discovery 21 (3), 181-200.
2. Sasso, J.M. et al. (2023) Molecular Glues: The Adhesive Connecting Targeted Protein Degradation to the Clinic. Biochemistry 62 (3), 601-623.
3. Yoon, H. et al. (2024) Induced protein degradation for therapeutics: past, present, and future. Journal of Clinical Investigation 134 (1), e175265.
4. Ito, T. et al. (2010) Identification of a Primary Target of Thalidomide Teratogenicity. Science 327 (5971), 1345-1350.
5. Tutter, A. et al. (2024) A small molecule VHL molecular glue degrader for cysteine dioxygenase 1.bioRxivhttps://doi.org/10.1101/2024.01.25.576086.
6. Han, T. et al. (2017) Anticancer sulfonamides target splicing by inducing RBM39 degradation via recruitment to DCAF15. Science 356 (6336), eaal3755.
7. Bulatov, E. and Ciulli, A. (2015) Targeting Cullin-RING E3 ubiquitin ligases for drug discovery: structure, assembly and small-molecule modulation. Biochem J 467 (3), 365-386.
8. Slabicki, M. et al. (2020) The CDK inhibitor CR8 acts as a molecular glue degrader that depletes cyclin K. Nature 585 (7824), 293-297.
9. Slabicki, M. et al. (2020) Small-molecule-induced polymerization triggers degradation of BCL6. Nature 588 (7836), 164-168.
10. Hsia, O.L.V. et al. (2024) Targeted protein degradation via intramolecular bivalent glues. Nature 627 (8002), 204-211.
论文作者介绍

仓勇
教授
仓勇,上海科技大学生命科学与技术学院教授、蛋白质靶向降解实验室主任。曾担任桑福德伯纳姆普雷比斯医学发现研究所的助理教授和浙江大学的教授。仓博士是达歌生物的联合创始人兼首席科学家。仓勇教授是靶向蛋白质降解、泛素连接酶生物学和癌症免疫治疗领域的科学领导者,在顶级生物医学期刊上发表了 30 多篇论文。仓教授开创了新型分子胶降解剂发现策略,重点是筛选方法开发和对分子胶药物、泛素连接酶和新底物之间相互作用的机制理解。

刘艳芬
副教授
刘艳芬,上海科技大学生命科学与技术学院副教授(Tenured)、博士生导师。刘艳芬课题组研究方向聚焦于蛋白质质量控制及其与人类疾病的机制联系。具体研究内容包括:1.自噬起始调控机制;2.内质网稳态调控机制;3.蛋白质质量控制和退行性疾病机制。代表成果发表在Autophagy (2021,2023,2024), Nature Communications (2023),TIBS (2023)等国际一流学术期刊,揭示了蛋白质质量控制系统的广泛作用机制。实验室网页:https://slst.shanghaitech.edu.cn/lyf/main.htm
相关论文信息
相关研究发表在Cell Press细胞出版社旗下期刊
Trends in Biochemical Sciences,
点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Routes to molecular glue degrader discovery
▌论文网址:
https://www.sciencedirect.com/science/article/abs/pii/S0968000424002780
▌DOI:
https://doi.org/10.1016/j.tibs.2024.12.006
▲长按识别二维码阅读论文
原标题:《上海科技大学刘艳芬/仓勇团队Trends in Biochemical Sciences综述|分子胶降解剂的发现途径》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2026 上海东方报业有限公司




