- +1
原创药GV-971治疗阿尔茨海默病的机理,科研团队揭示了
2018年7月17日,中国本土研制的抗阿尔茨海默病(AD)原创新药GV-971临床3期成功揭盲,在国内外引起了强烈反响。
去年10月25日,在巴塞罗那举行的第11届国际阿尔茨海默病临床试验大会上,GV-971第一发明人、中科院上海药物研究所耿美玉研究员代表上海绿谷制药有限公司及其科研团队和全国34家从事GV-971临床3期临床医院的研究者做了主旨发言,首次在全球披露GV-971临床3期数据,现场反响强烈,获得了与会顶尖国际专家的高度认可。
从GV-971的发现到临床3期试验成功完成至今,整个历程22年,这期间整个研发团队进行了艰苦卓越的工作。业界普遍关心的一个核心问题是,GV-971临床成功其作用机理是什么?
刚刚在Cell Research上在线发表的耿美玉研究团队的研究论文揭示了GV-971的作用机理,对发现AD治疗新方案具有重大的意义。
阿尔茨海默病(Alzheimer’s disease,AD)又称老年痴呆,是一种神经退行性脑部疾病。1906年Alois Alzheimer博士利用脑切片染色法发现老年痴呆患者脑内神经纤维缠结,伴有神经元细胞退化,并且大脑皮层出现很多斑块,于是将这种神经系统疾病命名为“阿尔茨海默病”。
随着现代医学的发展,人们发现AD特征性病理变化:大脑β淀粉样蛋白(β-amyloid,Aβ)沉积形成老年斑(Plaque),Tau蛋白过度磷酸化造成神经纤维缠结(NFTs)以及神经元丢失,并伴随胶质细胞增生。然而,AD的发病机理以及治疗依然是世界难题。
据《World Alzheimer Report 2018》统计,2018年全球有近5000万AD患者,到2050年预计将增加至1.52亿人。这对全球来说是极重的医疗负担。目前,美国FDA批准的六种AD治疗药物(卡巴拉汀、加兰他敏、多奈哌齐、美金刚、美金刚联合多奈哌齐和他克林)均为症状改善药物。这些药物既不能减轻AD的病理变化,也不能延缓疾病的病程进展。

9月6日,中国科学院上海药物研究所耿美玉课题组联合上海绿谷制药有限公司等研究团队在Cell Research杂志上发表了题为Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer’s disease progression的研究论文。
研究发现,在AD的进程中,肠道菌群失衡导致外周血中苯丙氨酸和异亮氨酸的异常增加,进而诱导外周促炎性Th1细胞的分化和增殖,并促进其脑内侵润。侵润入脑的Th1细胞和脑内固有的M1型小胶质细胞共同活化,导致AD相关神经炎症的发生。同步,该团队发现新型AD治疗药物GV-971通过重塑肠道菌群平衡、降低外周相关代谢产物苯丙氨酸/异亮氨酸的积累,减轻脑内神经炎症,进而改善认知障碍,达到治疗AD的效果。

目前研究证实,肠道菌群失衡与自闭症、抑郁症、帕金森症、阿尔茨海默病等神经系统疾病有密切联系。
在本研究中,作者首先确认了在AD进程中,肠道菌群的改变与脑内侵润的免疫细胞具有相关性。研究使用了常用的5XFAD转基因小鼠模型(Tg),他们发现,随着AD病程进展,Tg小鼠肠道菌群组成发生了显著改变。追踪Tg小鼠菌群结构的动态变化过程发现,在Tg小鼠2-3月龄时,拟杆菌门、厚壁菌门和疣微菌门丰度最高(Bacteroides 47.3%, Firmicutes 33.0% 和Verrucomicrobia 12.2%),然而到了7-9月龄时,则以厚壁菌门为主导(Firmicutes 62.8%)。这些结果表明随着AD的进展,Tg小鼠肠道菌群的组成结构发生了明显地改变。
有研究提示肠道菌群参与触发大脑神经炎症。因此,作者假设在AD进程中,以上菌群变化和神经炎症有密切关系。
首先,利用IBA1染色和流式细胞分析发现,Tg小鼠脑内小胶质细胞(Microglia)在2-3月龄和7-9月龄呈现两种截然不同的激活状态。在2-3月龄时,促炎的M1型和神经保护的M2型小胶质细胞活化都在增加,随着疾病的进展,促炎的M1型小胶质细胞持续增加,并在7-9月龄时达到顶峰,然而神经保护的M2型小胶质细胞在3-5月龄开始下降,之后就维持在一个较低的水平。
进一步分析AD进程中Tg小鼠脑中外周免疫细胞侵润情况,发现脑内外周侵润的CD45high细胞比例显著增高,并且CD4+ T细胞的两个主要亚型Th1和Th2表现出和促炎的M1型、神经保护的M2型小胶质细胞相似的变化过程。很明显随着肠道菌群的失衡,脑内的神经炎症模式转为以Th1细胞和M1型小胶质细胞活化为主导。
那么在AD的进程中,肠道菌群的丰度和大脑免疫细胞的变化是否有关联呢?作者分析发现在7-9月龄富集的肠道菌群与脑内Th1和M1细胞比例呈正相关(图1),这些结果表明,在AD的进程中,肠道菌群变化和脑内免疫细胞以及神经炎症密切相关。
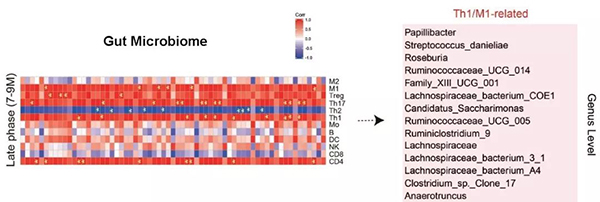
作者进一步从正反两个方面证实了肠道菌群是大脑免疫细胞侵润以及小胶质细胞激活所必需的。一方面利用抗生素处理Tg小鼠,使肠道菌群丰度显著降低,这时脑中侵润的Th1细胞比例和M1型小胶质细胞的活化也明显降低。
同窝饲养实验从另一个角度证实了肠道菌群对脑内神经炎症的驱动作用。同窝的野生型(WT)小鼠由于长期暴露于Tg小鼠的粪菌中,其体内的菌群组成更接近于Tg小鼠,使得其脑中Th1、M1细胞的比例显著升高、细胞因子的表达谱和认知功能也更接近于Tg小鼠。
短期的粪菌移植实验也同样证实,正常小鼠接受Tg小鼠粪菌后,脑中Th1细胞比例明显增加。相反,Tg小鼠接受正常小鼠粪菌后,脑中Th1细胞比例明显减少。这些结果都表明,在AD进程中,肠道菌群改变可以驱动脑内外周免疫细胞侵润以及神经炎症反应。
与此同时,作者验证了该团队研发的治疗AD的寡糖类原创新药GV-971对AD转基因小鼠认知功能障碍的改善作用。作者利用水迷宫和Y迷宫实验证实,AD模型小鼠接受GV-971治疗3个月后,认知功能障碍有明显改善(图2)。同时,在去年结束的为期36周、多中心、随机、双盲、治疗轻、中度AD患者的临床3期实验中,GV-971能够明显改善轻、中度AD患者的认知功能障碍。

那么,GV-971的作用机制是什么呢?
作者进一步探究了GV-971是否通过影响肠道菌群进而影响AD进程。作者发现5XFAD转基因小鼠(Tg)口服GV-971一个月后,肠道菌群的组成更接近于野生型小鼠,且肠道菌群的分布发生了明显的双向变化。与肠道菌群的变化一致,GV-971治疗Tg小鼠后,之前脑内免疫细胞与肠道菌群间的相关性被打破,脑内促炎性Th1细胞比例下降,小胶质细胞的活化水平也显著降低,同时,脑内多种细胞因子水平广泛下降(图3)。并且,GV-971的治疗显著降低了Tg小鼠脑内Aβ斑块沉积和Tau蛋白的磷酸化,对Tg小鼠辨别学习能力也有明显的改善作用。
这些结果表明,GV-971可以通过调节肠道菌群改善AD小鼠神经炎症和认知功能障碍。

许多研究表明肠道菌群可以通过代谢产物影响宿主的免疫系统。那么,在AD的进程中,肠道菌群是否通过代谢产物调节大脑神经炎症呢?
作者发现Tg小鼠粪菌培养上清可以刺激naïve CD4+T细胞更多地分化成促炎性Th1细胞,说明菌群产生的相关代谢产物可以调节免疫细胞分化。通过非靶向代谢组学分析发现WT、Tg和GV-971治疗的Tg小鼠粪便中存在31种差异的代谢产物,这些代谢产物在Tg小鼠中与WT小鼠相比显著升高或降低,同时这种改变在GV-971处理后可以明显逆转。通过通路富集,作者发现这些代谢物主要集中在一些氨基酸相关代谢通路,特别是苯丙氨酸(Phenylalanine)等相关通路。
氨基酸可以通过特定的转运体被免疫细胞摄取,从而驱动免疫细胞的分化和增殖。于是作者检测了苯丙氨酸和异亮氨酸转运体SLC7A5的表达水平。他们发现在Th1细胞中存在SLC7A5表达。用13C同位素标记苯丙氨酸表明Th1细胞能够摄取苯丙氨酸,并且这种摄取可以被SLC7A5抑制剂阻断。
进一步研究发现苯丙氨酸或异亮氨酸能刺激naïve CD4+T细胞分化成Th1细胞,并可刺激Th1细胞的增殖。当给WT小鼠腹腔注射苯丙氨酸或异亮氨酸时,小鼠血液中Th1细胞的比例也显著增加。
GV-971 处理一个月可明显降低Tg小鼠粪便和血液样本中苯丙氨酸和异亮氨酸的含量,并且减少苯丙氨酸或异亮氨酸所诱导的Th1细胞的分化,同步降低苯丙氨酸诱导的Th1细胞增殖。
为了进一步验证上述小鼠模型上的研究结果是否在临床样本上具有可重现性,作者又比较了轻度认知障碍AD患者和对应年龄段的健康人血液中苯丙氨酸、异亮氨酸和Th1免疫细胞等含量的差别,结果发现轻度认知障碍AD患者Phe/Ile水平和Th1细胞含量比例较健康人均明显升高,提示了该工作具有潜在的临床转化价值。

综上,在AD进程中,伴随Aβ的沉积以及Tau蛋白的磷酸化的发生,肠道菌群的组成发生变化,继而导致代谢产物异常,异常的代谢产物刺激外周免疫炎症,促使炎性免疫细胞Th1向大脑侵润,引起脑内M1型小胶质细胞的活化,导致AD相关神经炎症的发生,最终导致认知功能障碍。口服GV-971能够重塑肠道菌群,降低异常代谢产物,阻止外周炎性免疫细胞向大脑的侵润,抑制神经炎症,同时减少Aβ的沉积和Tau蛋白的磷酸化,从而改善认知障碍,达到治疗AD的目的(图4)。
(原题为《Cell Research特别报道 | 耿美玉团队揭示中国原创阿尔茨海默病新药GV-971的作用机理》,有删减)
(原题为《Cell Research特别报道 | 耿美玉团队揭示中国原创阿尔茨海默病新药GV-971的作用机理》)




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




