- +1
饶子和等人绘出新冠“小尾巴”的三维结构:正是瑞德西韦靶标
当地时间3月17日,生物医学预印本平台bioRxiv发布了一项题为“Structure of RNA-dependent RNA polymerase from 2019-nCoV, a major antiviral drug target”(未经同行审议)的研究成果。中外多所高校的科研团队率先在国际上成功解析了新型冠状病毒RNA依赖性RNA聚合酶(RdRp)的结构。
新冠病毒固然“狡猾”,但其也有“小尾巴”,这便是RdRp。瑞德西韦“揪住”的正是RdRp,以此攻击新冠的命门。RdRp能够催化病毒RNA的合成,是冠状病毒复制/转录机制的关键组成部分,以RNA聚合酶为核心,病毒会利用其它辅助因子(如nsp7、nsp8等)进行自我复制。用冷冻电镜“绘出”RdRp的三维结构,将有助于科学家攻克抑制新冠病毒复制的难题。
值得一提的是,RdRp也是瑞德西韦等抗病毒药物的主要靶标,当药物进入人体,通过代谢后,其最终产物就直接靶
RdRp是主要的抗病毒药物靶点,也是当下被寄予很大希望的瑞德西韦等抗病毒药物的主要靶标。作者们认为,这一研究将为开发针对新冠肺炎的药物奠定重要基础。
该文章的科研团队包括:清华大学结构生物学实验室、上海科技大学高级免疫化学研究所生命学院、南开大学药物化学生物学国家重点实验室、广西大学亚热带农业生物保护利用国家重点实验室、天津大学生命科学学院、中国科学院生物大分子研究中心,以及澳大利亚昆士兰大学化学及太空分子生物学系等。
文章通讯作者为上海科技大学免疫化学研究所研究员王权,清华大学教授娄智勇,清华大学教授、上海科技大学特聘教授、中国科学院院士饶子和。
饶子和团队在SARS(严重急性呼吸综合征)疫情暴发期间,是全球首个解析SARS病毒蛋白质(主要蛋白酶)三维结构的团队。在此次新冠肺炎疫情中,饶子和院士/杨海涛教授团队和蒋华良院士团队合作,率先在国际上解析了首个新型冠状病毒蛋白质(主要蛋白酶)与抑制剂复合物的高分辨率三维结构。
新冠病毒RdRp的冷冻电镜结构
RdRp(也称为nsp12)能够催化病毒RNA的合成,是冠状病毒复制/转录机制的关键组成部分,以RNA聚合酶为核心,病毒会利用其它辅助因子(如nsp7、nsp8等)进行自我复制。
值得一提的是,RdRp也是瑞德西韦等抗病毒药物的主要靶标,当药物进入人体,通过代谢后,其最终产物就直接靶向病毒的RNA聚合酶。
在收集和处理了7994份电镜图片后,研究人员解析了新型冠状病毒全长nsp12与辅助因子nsp7和nsp8组成的复合物的冷冻电镜三维空间结构,分辨率达2.9埃。
研究人员发现,除了病毒聚合酶家族聚合酶核心的保守结构和冠状病毒RdRp中特有的NiRAN结构域外,nsp12在其N末端还有一个新发现的β-发夹结构域(β-hairpin domain)。
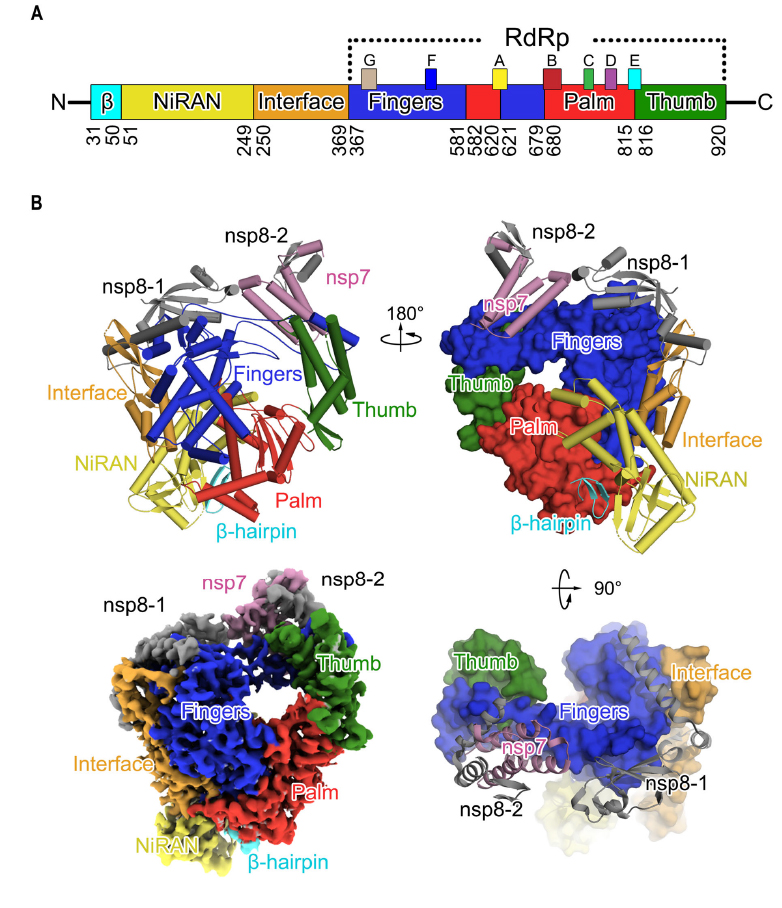
新冠病毒nsp12的结构包含一个“右手”(“right hand”)聚合酶结构域和一个包含有病毒RdRp相关的核苷酸转移酶(NiRAN)的Nidovirus独有的N端延伸域架构,它们通过接口域(A250-F369残基)连接。
“右手”(“right hand”)聚合酶结构域呈现出病毒聚合酶家族的保守结构,由3个亚结构域组成,包括1个手指(fingers)亚结构域、1个手掌(palm)亚结构域和1个拇指(thumb)亚结构域。
在冷冻电镜图谱下,研究人员还构建了另外1个N末端的β-发夹结构,它插入到由NiRAN结构域和RdRp结构域组成的手掌(palm)结构域钳制的凹槽中。与SARS-CoV nsp7-nsp8对相似,新冠病毒nsp7-nsp8对也显示出保守结构。
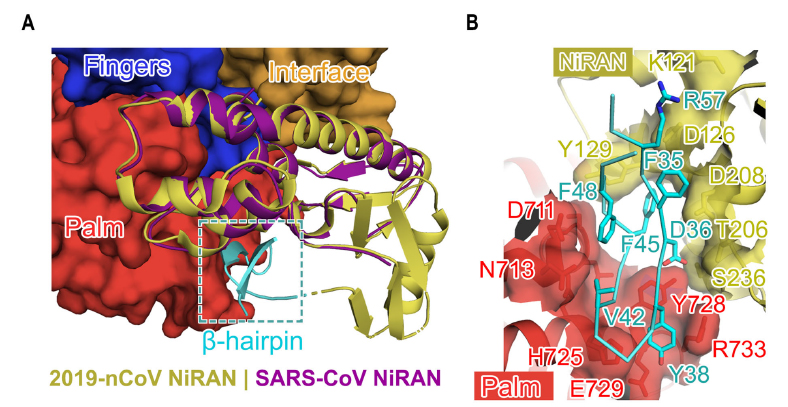
新冠病毒的N末端NiRAN结构域和β-发夹结构
研究人员指出,尽管新冠病毒nsp12-nsp7-nsp8复合物的总体结构大体上与SARS冠状病毒相似,但仍有一些关键特征是不同的。
第一,冷冻电镜图谱使研究团队能够构建涵盖几乎所有残基的2019-nCoV(2019新型冠状病毒)的nsp12结构,从而首次深入了解了冠状病毒RdRp的完整架构。SARS病毒nsp12的末端有7个带有三链β-折叠的螺旋,它们构成了NiRAN域。而在2019-nCoV中,残基Y69-R118构成具有3个反平行β链和一个螺旋的附加结构嵌段,残基N215-D218在nsp12中形成β链。
研究人员认为,该区域与链(残基V96-A100)的接触有助于使其稳定。最终,这四根链形成了紧凑的半β-桶形结构。
第二,通过冷冻电镜图谱,研究人员识别了新冠病毒中独特的N末端β-发夹结构。该结构插入由NiRAN域和RdRp域中的手掌子域夹住的凹槽中,并形成一组紧密接触以稳定整体结构。
第三,与SARS病毒不同,研究人员在2019-nCoV nsp12对应位置中未观察到被螯合的锌离子。相反,图像显示C301-C306和C487-C645在结构中形成了二硫键。研究人员推断,是不同的纯化缓冲液、冷冻电镜采样和重建方法导致了这种差异。
瑞德西韦作用于2019-nCoV nsp12
瑞德西韦(GS-5734)是一款腺嘌呤类似物的药物前体,由吉利德科学公司(Gilead Sciences)研发,尚未在全球在任何地方获得许可或批准,据报道,在临床上它可以抑制2019-nCoV增殖并具有治疗患者的潜力。
但是,目前为止瑞德西韦如何精确靶向病毒RNA聚合酶的机制仍不明了,这成为了进一步开发更有效的抗病毒药物的阻碍。
据此前《自然综述·药物发现》(Nature Reviews Drug Discovery)在线发表的COVID-19治疗方案综述文章,包括瑞德西韦在内的核苷类似物通常为腺嘌呤或鸟嘌呤的衍生物,它们能够被RdRP使用合成RNA链,在包括人类冠状病毒在内的多种RNA病毒中阻断病毒RNA的合成。
瑞德西韦的结构与已经获批的艾滋病病毒(HIV)逆转录酶抑制剂替诺福韦艾拉芬酰胺(tenofovir alafenamide)类似。瑞德西韦等链终止核苷酸类似物的功效需要通过识别病毒RdRps将抑制剂的活性形式掺入正在生长的RNA链中。
由于2019-nCoV和HCV(丙型肝炎)ns5b聚合酶之间在催化腔上的结构保守性,以及瑞德西韦和sofosbuvir(索非布韦,靶向HCV ns5b的药物,已被批准用于治疗慢性HCV感染)的可能相似的作用机理,研究团队提出了瑞德西韦在2019-nCoV nsp12中的纳入模型。
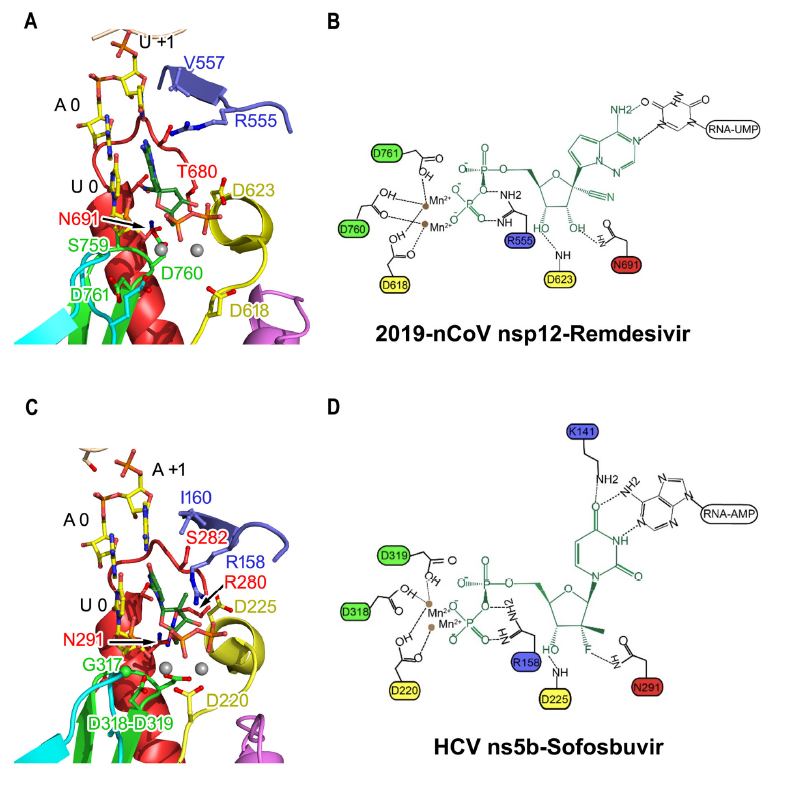
两种药物作用于2019-nCoV nsp12的纳入模型,AB代表瑞德西韦,CD为索非布韦
研究人员发现,在2019-nCoV nsp12中,瑞德西韦的多个羟基可能与基序作用,此外,基序F中的1个侧链可能会与进入的三磷酸瑞德西韦(ppp-remdesivir)进行碱基配对。
在几种人体细胞系中,瑞德西韦可以有效地代谢为活性核苷三磷酸。一项体外研究表明,核苷三磷酸与三磷酸腺苷形成联合竞争,干扰病毒的RdRp,类似扮演延迟RNA链终止子的角色,避免病毒外核糖核酸酶的校正,并导致病毒RNA产量下降。
作者们在文章最后写道,2019-nCoV在全球的迅速传播强调了开发新的冠状病毒疫苗和治疗剂的必要性。新冠病毒聚合酶nsp12看起来是新疗法的绝佳靶标,特别是考虑到瑞德西韦等抑制剂已经在研发过程中。
新冠病毒RdRP以及其他有希望的药物靶标(例如主要蛋白酶),将支持抗冠状病毒鸡尾酒疗法的开发,这些治疗手段可以进一步被用于冠状病毒广谱抗病毒药物的研发。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




