- +1
非典治愈者的抗体可强力抑制新冠病毒,为疫苗设计提供线索
疫苗和其他治疗方案对于遏制人畜共患病毒SARS-CoV-2的大流行至关重要。最新研究发现:非典(SARS)康复者体内的一种抗体能够强力抑制新冠病毒,提供交叉中和作用。这对设计新冠病毒疫苗以及药物治疗有着重要的借鉴意义。
以上研究来国际权威学术期刊《自然》5月18日以“加快评审文章”(Accelerated Article Preview)形式在线发表的一篇论文。研究名为“Cross-neutralization of SARS-CoV-2 by a human monoclonal SARS-CoV antibody(SARS-CoV人类单克隆抗体对SARS-CoV-2的交叉中和作用)”。研究团队包括美国华盛顿大学、瑞士Humabs Biomed SA等,通讯作者为美国华盛顿大学生物化学系教授戴维·韦斯勒(David Veesler)与瑞士Vir Biotechnology的子公司Humabs Biomed SA的戴维德·科蒂(Davide Corti)。
此前已有研究显示,SARS-CoV-2的刺突(S)糖蛋白让病毒最终得以进入宿主细胞,因此S刺突糖蛋白是中和抗体的主要靶标。
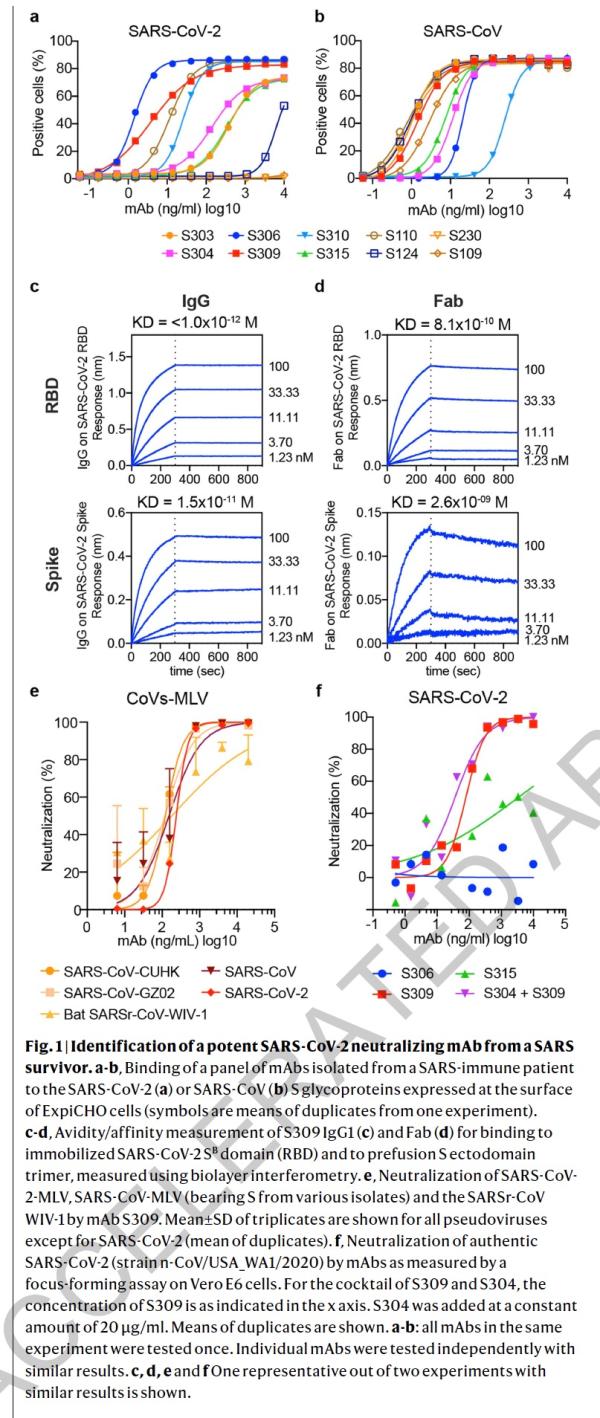
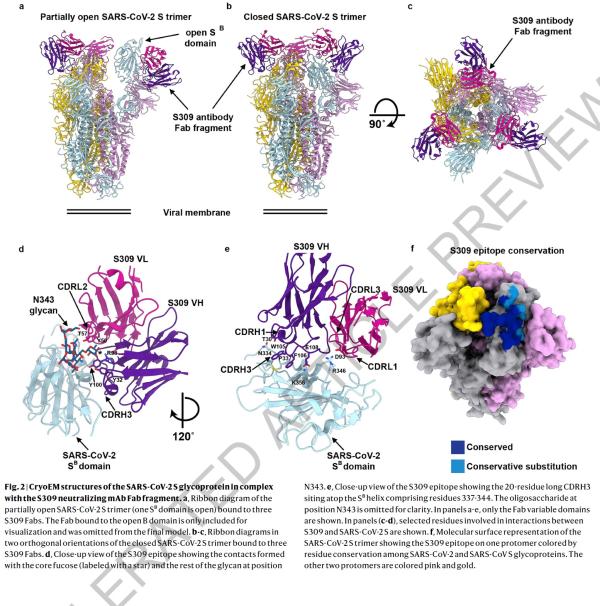
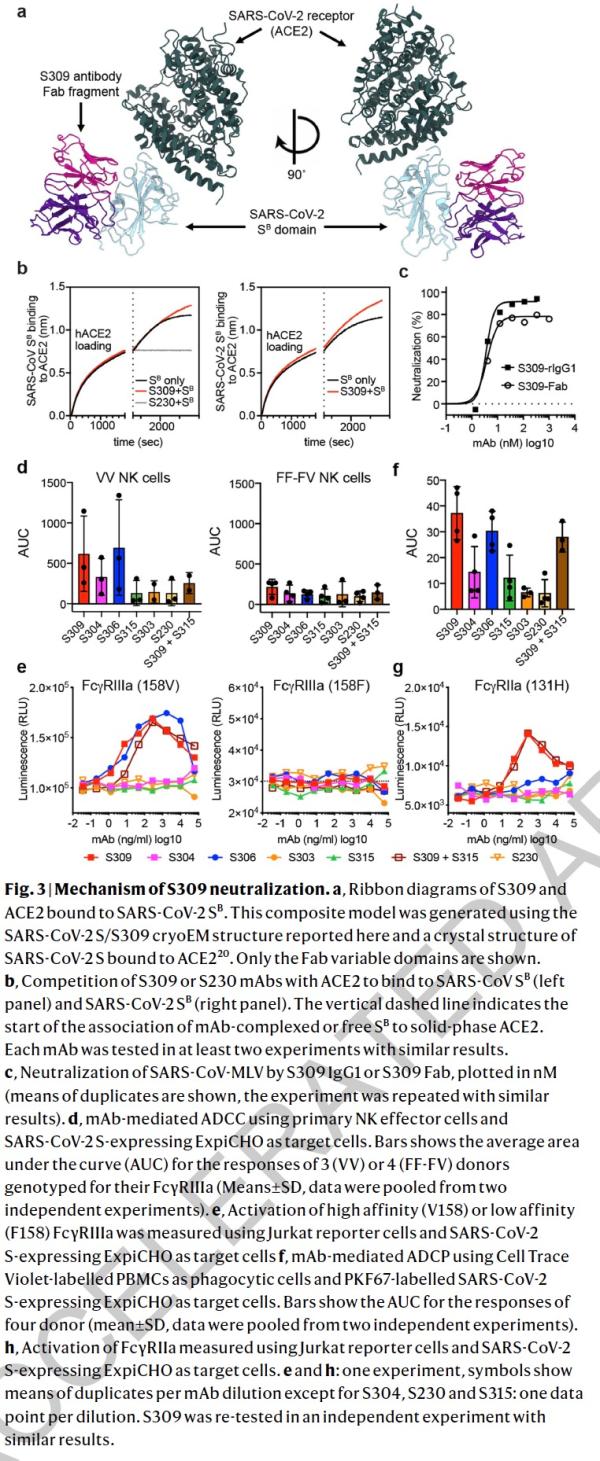
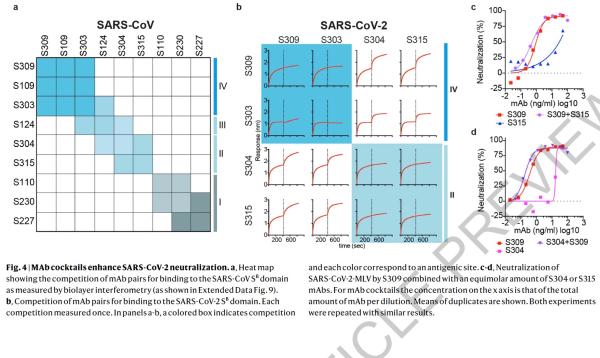
本研究中,研究人员从2003年非典康复者的记忆B细胞中鉴定出来多种针对SARS-CoV-2 S蛋白的单克隆抗体。研究了其中25株抗体抑制SARS-CoV-2的潜力(即交叉反应性),科学家发现有8株可以与脱毒和感染的细胞结合。其中,一种名为S309的抗体具有强力中和效果。S309可以有效地中和SARS-CoV-2和SARS-CoV假病毒,并通过结合S受体结合结构域来鉴定出真正的SARS-CoV-2病毒。
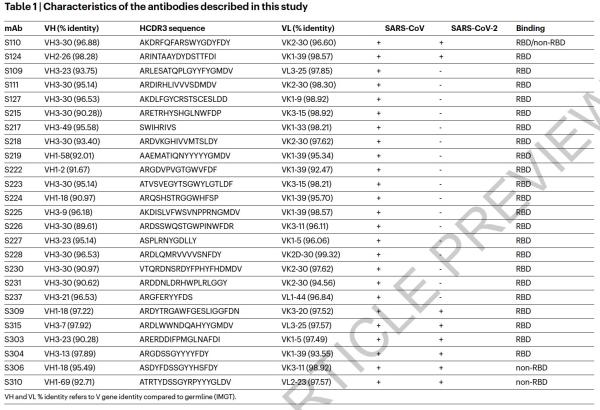
研究人员使用冷冻电子显微镜和结合测定法,表明S309可以识别sarbecovirus亚属病毒内保守的含聚糖表位,而不会与受体产生结合竞争。包含S309抗体以及其他抗体的混合物能够进一步增强对SARS-CoV-2的中和,并可能限制某些导致中和逃逸效应的突变体出现。这些结果为使用S309抗体和含S309的抗体混合物为高暴露风险个人提供防护,并为治疗重症患者铺平了道路。
论文指出,冠状病毒进入宿主细胞是由跨膜刺突糖蛋白介导,该蛋白从病毒表面形成突出的同型三聚体。 刺突糖蛋白包含两个功能亚基:负责结合宿主细胞受体的S1(分为A,B,C和D结构域)和促进病毒膜与细胞膜融合的S2。SARS-CoV-2和SARS-CoV均属于sarbecovirus亚属,其刺突糖蛋白80%的氨基酸序列相同。 SARS-CoV-2 S与蝙蝠SARS相关冠状病毒(SARSr-CoV)中的RaTG13密切相关,97.2%的氨基酸序列相同。研究者和其他人最近证明,与SARS-CoV一样,人类血管紧张素转换酶2(hACE2)是SARS-CoV-2的功能性受体。 S结构B域是受体结合域(RBD),与人类受体hACE2的结合具有高亲和力,这可能是新冠病毒在人类中快速传播的原因。
由于冠状病毒刺突糖蛋白介导进入宿主细胞,它是中和抗体的主要目标,也是药物治疗和疫苗设计工作的重点。 刺突的三聚体被N-连接的聚糖广泛修饰,这对于蛋白质折叠和调节宿主蛋白酶和中和抗体的可到达性而言至关重要。用冷冻电镜获得SARS-CoV-2 的刺突糖蛋白在两个不同功能状态下的结构,以及与hACE2结合的SARS-CoV-2 S结构B域的晶体结构揭示了其动态状态,为疫苗和病毒抑制剂的设计提供了参考。
单克隆抗体(mAb)可以为个人提供即时保护,促进疫苗开发,对控制SARS-CoV-2大流行具有重大的影响。在大流行的背景下,单克隆抗体的研发可以大幅加速,压缩至数月。最近发现ansuvimab(mAb114)是针对埃博拉病毒感染的安全有效疗法,这也是传染病暴发期间成功使用单克隆抗体治疗的一个突出例子。
研究者先前从感染SARS-CoV或MERS-CoV的患者们体内的记忆B细胞中鉴定出具有强力中和能力的人类单克隆抗体。这些单克隆抗体能够保护受到各种SARS-CoV和SARS相关CoV(SARSr-CoV)以及MERS-CoV病毒攻击的动物。这两种单克隆抗体与SARS-CoV S和MERS-CoV S的复合结构表征提供了有关病毒中和机理的分子信息。值得注意的是,尽管两个单克隆抗体都阻止了S结构B域与宿主受体的附着,但单克隆抗体S230对 SARS-CoV的中和是通过模仿受体的附着,并促进了刺突糖蛋白融合构象的重排。
这项概念验证研究表明,混合使用单克隆抗体或许是值得探索的一种控制SARS-CoV-2的方法。但是,这项研究并未开展任何人体试验。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




